
- •Лабораторно-практическое занятие №2
- •§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
- •§2 Характеристики и свойства ковалентной связи.
- •§3 Ионная связь, ее возникновение. Особенности ионной связи.
- •§4 Водородная связь; виды водородной связи.
- •§5. Индуктивный эффект.
- •§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
- •§7 Мезомерный эффект.
- •§8 Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №3
- •§1 Основные положения теории Бренстеда-Лоури и Льюиса.
- •§2. Сила кислот и оснований Бренстеда. Шкала кислотности рКа и рКв.
- •§3. Факторы, определяющие кислотность.
- •§4. Теория Льюиса.
- •§5. Экспериментальная часть
- •§6 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №4
- •§1. Алканы. Номенклатура, изомерия. Способы получения.
- •§2.Физические свойства:
- •§3. Химические свойства
- •Сульфохлорирование и сульфоокисление.
- •Дегидрирование.
- •Изомеризация.
- •§4. Циклоалканы
- •§5. Химические свойства.
- •§6. Алкены. Номенклатура, изомерия. Способы получения.
- •§7. Химические свойства
- •Гидрогалогенирование.
- •3.Гидратация
- •Присоединение серной кислоты.
- •Окисление кислородом воздуха без катализатора.
- •Окисление кислородом воздуха в присутствии серебряного катализатора.
- •Гидроксилирование.
- •Жесткое окисление.
- •V. Полимеризация.
- •§8. Экспериментальная часть
- •§9 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №5
- •§1. Алкины. Номенклатура, изомерия.
- •§2. Электронное строение
- •§3. Получение алкинов
- •§4. Физические свойства
- •§5. Химические свойства ацетиленовых углеводородов
- •§6. Алкадиены; классификация, изомерия, номенклатура. Получение диенов.
- •§7. Особенности химического строения алкадиенов с сопряженными связями
- •§8. Химические свойства
- •§9. Экспериментальная часть
- •§10. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №6
- •§1. Ароматические углеводороды. Общая характеристика,
- •§2. Физические свойства аренов. Способы получения.
- •§3. Электронное строение на примере бензола. Ароматичность;
- •§4. Химические свойства
- •§5. Понятие о многоядерных аренах. Конденсированные арены
- •§6. Химические свойства
- •§7. Экспериментальная часть
- •§8. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №7 Итоговое занятие № 1
- •Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
- •Лабораторно-практическое занятие №13
- •§1. Классификация, номенклатура, изомерия карбоновых кислот.
- •Изомерия карбоновых кислот
- •§2. Способы получения
- •§3. Физические свойства
- •§4. Химические свойства
- •§5. Применение:
- •§6. Дикарбоновые кислоты
- •§7. Способы получения
- •§8. Физические свойства
- •§9. Химические свойства
- •§10. Применение:
- •§11. Экспериментальная часть
- •§12. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №13 Тема: «Гетерофункциональные органические соединения»
- •§1. Гидроксикислоты; номенклатура, изомерия, классификация.
- •§2. Оптическая (зеркальная) изомерия молочной и винной кислот.
- •§3. Методы получения оксикислот.
- •§4. Химические свойства
- •§5. Специфические свойства гидроксикислоты
- •§6. Фенолокислоты
- •§7. Альдегидо- и кетокислоты, способы их получения
- •Кетокислоты
- •§8 Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №14 Тема: «Аминокислоты, пептиды, белки»
- •§1. Аминокислоты; строение, изомерия. Классификация.
- •§2. Способы получения аминокислот.
- •§3. Особенности строения природных аминокислот.
- •§4. Химические свойства аминокислот
- •§5. Специфические реакции аминокислот
- •§6 Образование пептидов; строение пептидной группы. Понятие о первичной структуре белка.
- •Уровня пространственной организации белковых молекул.
- •§7. Аминобензойные кислоты
- •§8. Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №15 Итоговое занятие № 3
§5. Индуктивный эффект.
Связующие электроны ковалентной связи расположены абсолютно симметрично между атомными ядрами лишь в случае одинаковых атомов (Н-Н, О=О).
Когда ковалентная связь соединяет атомы разной элктроотрицательности,
центр тяжести положительных зарядов ядер не совпадает с центром тяжести
о трицательных
зарядов электронов: связь приобретает
дипольный момент μ=q∙l
трицательных
зарядов электронов: связь приобретает
дипольный момент μ=q∙l
(q-заряд, l-расстояние между центрами тяжести зарядов). Полярность связи возрастает с увеличением разности электроотрицательностей связанных атомов. Полярную ковалентную связь в общем виде можно представить как Аδ+ :Вδ- . Знаки δ+, δ- обозначают направление поляризации: эти знаки обычно символизируют малые доли элементарного заряда
С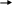
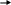
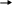 δ+
Сlδ-
Сδ+
Оδ-Н
Сδ+=Оδ-
Сδ+
Nδ-
H2
δ+
Сlδ-
Сδ+
Оδ-Н
Сδ+=Оδ-
Сδ+
Nδ-
H2
Полярность одной ковалентной связи является причиной смещения электронной плотности соседних σ-связей также в сторону более электроотрицательного элемента.
Индуктивный эффект ( I-эффект) – это передача электронного заместителей по цепи σ-связей.
Индуктивный эффект передается по цепи σ-связей с постепенным затуханием и, как правило, через две- три связи он уже не проявляется. В наибольшей степени этот эффект сказывается на ближайших соседних связях.
Направление индуктивного эффекта заместителя принято качественно оценивать путем сравнения с атомом Н, полагая его I-эффект равным 0.
Знак индуктивного эффекта принято определять по заряду, который приобретает заместитель.
Электроноакцепторные заместители, уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект ( -I ).
δ'''+ δ''+ δ'+ δ-
С
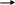
 Н3
СН2
СН2
Х -IХ
– эффект
Н3
СН2
СН2
Х -IХ
– эффект
δ'''+ < δ''+ < δ'+
К электроноакцепторным заместителям (X) относятся
-F, - Cl, -Br, -I
-OH, -OR
-NH2, -NR2, -NR3
>C=O, -COOH
- NO2, - SO3H
Эти заместители оттягивают на себя общую электронную пару σ-связи и вызывают появление частичных положительных зарядов (δ+) на соседних атомах, например
δ'''+ δ''+ δ'+ δ-
С Н3 СН2 СН2 Cl -ICl – эффект
Электронодонорные заместители, увеличивающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект ( +I )
δ'''- δ''- δ' - δ+
С
 Н3
СН2
СН2
Y
+IY
– эффект
Н3
СН2
СН2
Y
+IY
– эффект
δ'''- < δ''- < δ'-
К электронодонорным заместителям (Y) относятся
алкильные группы -CH3 , -CH2 –CH3, -CH(CH3)2 , -C(CH3)3
анионы -О¯, -S¯, MgCl¯
атомы металлов Na, Mg, Al и т.д.
Эти заместители повышают электронную плотность в цепи и вызывают появление частичных отрицательных зарядов (δ-) на соседних атомах, например
δ'''- δ''- δ' - δ+
С Н3 СН2 СН2 MgCl +IMgCl – эффект
§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
р- и π-π- сопряжение.
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных
р-орбиталей.
Делокализованная связь – это ковалентная связь, молекулярные орбитали которой охватывают более двух атомов. р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя общую π-электронную систему.
Делокализованные молекулярные орбитали могут принадлежать двум или более
π-связям, тогда такой тип сопряжения называют π,π-сопряжением.
Примерами π,π- сопряженных систем являются
![]()
![]()
![]()
бутадиен – 1,3 винилацетилен акрилонитрил

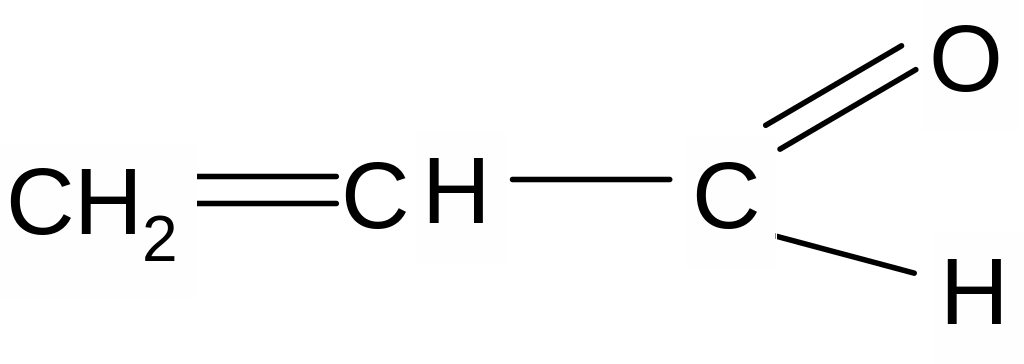
изопрен акролеин
Простейшим представителем π,π- сопряженных систем является бутадиен-1,3. В его молекуле все атомы углерода находятся в sp2 –гибридизации: три sp2-гибридные орбитали каждого атома углерода лежат в одной плоскости под углом 120º. При их взаимном перекрывании и при перекрывании с электронными орбиталями атомов водорода образуется σ-скелет:
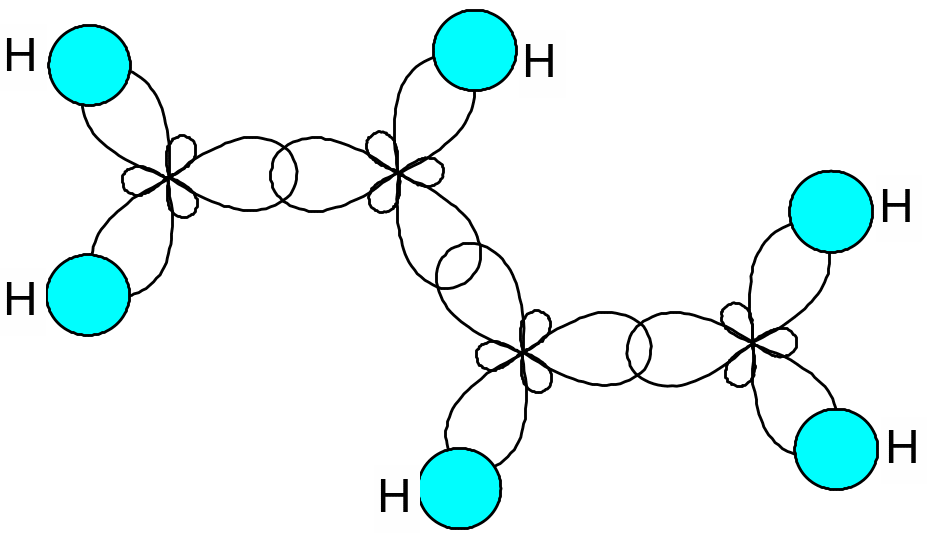
Негибридные р-орбитали каждого атома углерода перпендикулярны плоскости σ-скелета и параллельны друг другу, что способствует их взаимному перекрыванию и образованию единого π-электронного облака:

Результат такого сопряжения можно изобразить в виде граничных(или резонансных) структур:
δ+ δ-

В реальной молекуле ни одна из структур I или III не осуществляется, а электроны занимают в молекуле стабильное положение, отвечающее в действительности структуре II.
Дополнительное перекрывание р-орбиталей приводит к делокализации
π-электронов в сопряженной системе и сопровождается
- выравниванием длины связи: l(C1-C2 , C3-C4) = 0,137нм, l(С2-С3)=0,147нм
- выделением энергии;
поэтому сопряженные соединения обладают меньшим запасом энергии. Они стабильнее, чем соединения с изолированными кратными связями. Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения (энергия резонанса).
р,π-Сопряжение осуществляется в том случае, когда орбитали двойных (или тройных) π-связей перекрываются с р-орбиталью соседнего атома и образуется единая делокализованная система π-электронов. р,π-Сопряжение осуществляется в молекулах, содержащих фрагмент С=С – Х:, где Х – гетероатом, имеющий свободную пару электронов на р-орбитали:
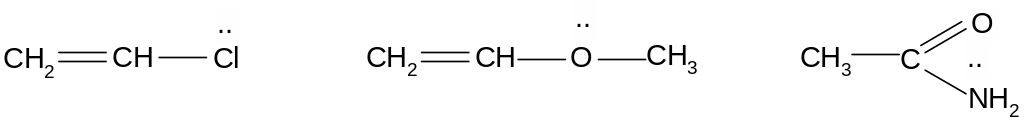
винилхлорид винилметиловый эфир ацетамид
Сопряженные системы с замкнутой цепью.
К этому типу систем относятся ароматические соединения: бензол и сходные с ним по строению и химическому поведению вещества, гетероциклические соединения, небензоидные ароматические соединения.
Бензол как прототип ароматических соединений:

Каждый атом углерода в молекуле находится в sp²-гибридизации; все σ-связи
С – С и С – Н лежат в одной плоскости под углом 120º; негибридизованные


σ – скелет π-облако
р-орбитали перпендикулярны плоскости σ – скелета и параллельны друг другу. При взаимном перекрывании образуется единое шестиэлектронное π-облако, которое равномерно распределяется по всей циклической системе. Такое строение молекулы бензола приводит к выравниванию длины связи (lС-С =0,120нм) и выигрышу энергии (Есопряж.=150 кДж/моль). Это свидетельствует о повышенной термодинамической стабильности бензола.
