- •Лабораторно-практическое занятие №2
- •§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
- •§2 Характеристики и свойства ковалентной связи.
- •§3 Ионная связь, ее возникновение. Особенности ионной связи.
- •§4 Водородная связь; виды водородной связи.
- •§5. Индуктивный эффект.
- •§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
- •§7 Мезомерный эффект.
- •§8 Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №3
- •§1 Основные положения теории Бренстеда-Лоури и Льюиса.
- •§2. Сила кислот и оснований Бренстеда. Шкала кислотности рКа и рКв.
- •§3. Факторы, определяющие кислотность.
- •§4. Теория Льюиса.
- •§5. Экспериментальная часть
- •§6 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №4
- •§1. Алканы. Номенклатура, изомерия. Способы получения.
- •§2.Физические свойства:
- •§3. Химические свойства
- •Сульфохлорирование и сульфоокисление.
- •Дегидрирование.
- •Изомеризация.
- •§4. Циклоалканы
- •§5. Химические свойства.
- •§6. Алкены. Номенклатура, изомерия. Способы получения.
- •§7. Химические свойства
- •Гидрогалогенирование.
- •3.Гидратация
- •Присоединение серной кислоты.
- •Окисление кислородом воздуха без катализатора.
- •Окисление кислородом воздуха в присутствии серебряного катализатора.
- •Гидроксилирование.
- •Жесткое окисление.
- •V. Полимеризация.
- •§8. Экспериментальная часть
- •§9 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №5
- •§1. Алкины. Номенклатура, изомерия.
- •§2. Электронное строение
- •§3. Получение алкинов
- •§4. Физические свойства
- •§5. Химические свойства ацетиленовых углеводородов
- •§6. Алкадиены; классификация, изомерия, номенклатура. Получение диенов.
- •§7. Особенности химического строения алкадиенов с сопряженными связями
- •§8. Химические свойства
- •§9. Экспериментальная часть
- •§10. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №6
- •§1. Ароматические углеводороды. Общая характеристика,
- •§2. Физические свойства аренов. Способы получения.
- •§3. Электронное строение на примере бензола. Ароматичность;
- •§4. Химические свойства
- •§5. Понятие о многоядерных аренах. Конденсированные арены
- •§6. Химические свойства
- •§7. Экспериментальная часть
- •§8. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №7 Итоговое занятие № 1
- •Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
- •Лабораторно-практическое занятие №13
- •§1. Классификация, номенклатура, изомерия карбоновых кислот.
- •Изомерия карбоновых кислот
- •§2. Способы получения
- •§3. Физические свойства
- •§4. Химические свойства
- •§5. Применение:
- •§6. Дикарбоновые кислоты
- •§7. Способы получения
- •§8. Физические свойства
- •§9. Химические свойства
- •§10. Применение:
- •§11. Экспериментальная часть
- •§12. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №13 Тема: «Гетерофункциональные органические соединения»
- •§1. Гидроксикислоты; номенклатура, изомерия, классификация.
- •§2. Оптическая (зеркальная) изомерия молочной и винной кислот.
- •§3. Методы получения оксикислот.
- •§4. Химические свойства
- •§5. Специфические свойства гидроксикислоты
- •§6. Фенолокислоты
- •§7. Альдегидо- и кетокислоты, способы их получения
- •Кетокислоты
- •§8 Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №14 Тема: «Аминокислоты, пептиды, белки»
- •§1. Аминокислоты; строение, изомерия. Классификация.
- •§2. Способы получения аминокислот.
- •§3. Особенности строения природных аминокислот.
- •§4. Химические свойства аминокислот
- •§5. Специфические реакции аминокислот
- •§6 Образование пептидов; строение пептидной группы. Понятие о первичной структуре белка.
- •Уровня пространственной организации белковых молекул.
- •§7. Аминобензойные кислоты
- •§8. Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №15 Итоговое занятие № 3
§2. Способы получения
Окислительные методы
Окисление алканов приводит к образованию смесей кислот, образующихся за
счет разрыва цепи вследствие окисления разных метиленовых звеньев.
![]()
Окисление первичных спиртов через стадию получения альдегида (или
непосредственно) в кислоты с тем же числом углеродных атомов:
R – CH2OH
![]() R
– C (O) H + H2O
R
– COOH
R
– C (O) H + H2O
R
– COOH
Окисление карбонильных соединений
а) альдегиды окисляются аммиачным раствором оксида серебра, комплексными соединениями меди (II) в щелочной среде (Фелингова жидкость), Н2О2, CrO3, KMnO4, HNO3, O2 (катализаторы – соли Со и Mn)
R – C(O)H R – COOH
б) кетоны окисляются энергичными окислителями (КМnО4) в смесь карбоновых кислот по правилу Попова А.Н.:
СН3 – СН2 – СН2 – СН2 – С(О) – СН2 – СН3 + [O] →
→ СН3СН2СН2СООН + СН3СН2СООН +
+ СН3СН2СН2СН2СООН + СН3СООН
Гидролитические методы
гидролиз трихлорметилпроизводных
R – CCl3
+ 2H2O![]() R
– COOH + 3HCl
R
– COOH + 3HCl
гидролиз нитрилов
R – C ≡ N + 2H2O R – COOH + NH3
гидролиз сложных эфиров, амидов, галогенангидридов
карбоновых кислот.

III.Карбонилирование и гидроксикарбоксилирование (способы с удлинением цепи углеродных атомов).

![]()
Некоторые специфические методы.
Синтез муравьиной кислоты:
СО + NaОН![]() НСООNa
НСООNa![]() НСООН
+ NaCl
НСООН
+ NaCl
Брожение – получение масляной кислоты:
С6Н12О6(р–р)
![]() С3Н7СООН
+ 2СО2↑
+ 2Н2↑
С3Н7СООН
+ 2СО2↑
+ 2Н2↑
§3. Физические свойства
Монокарбоновые кислоты с С1 до С9 – бесцветные жидкости;
ароматические, высшие алифатические – твердые вещества.
Муравьиная, уксусная и пропионовая кислоты имеют резкий раздражающий запах, остальные кислоты с неприятным запахом.
Муравьиная, уксусная и пропионовая кислоты с водой смешиваются в любых соотношениях.
3 – 6% - ный раствор уксусной кислоты называется «столовым уксусом».
С увеличением углеродной цепи растворимость в воде уменьшается и возрастает гидрофобность.
Температуры кипения монокарбоновых кислот выше температуры кипения соответствующих спиртов и альдегидов, что объясняется способностью кислот к ассоциации за счет водородных связей.
В твердом и жидком состоянии кислоты в результате возникновения водородных связей образуют устойчивые циклические димеры:
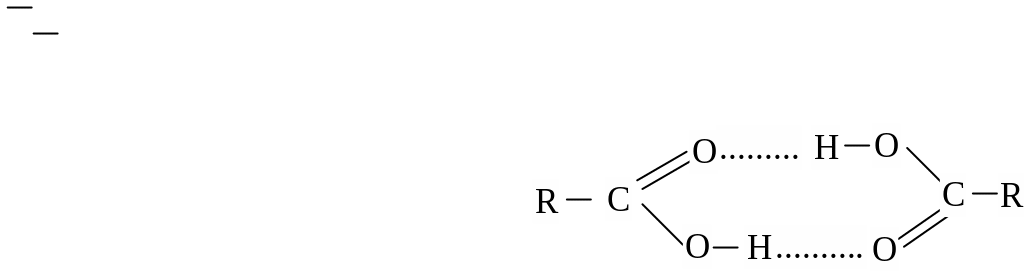
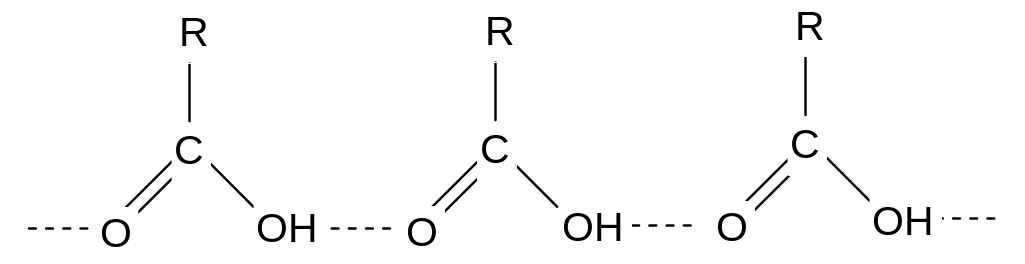
В водных растворах кислоты образуют ациклические димеры и олигомеры.

Электронное строение карбоксильной группы: р,π – сопряженная система

Длина связи С=О – 0,118 – 0,126 нм
Длина связи С – О – 0,121 – 0,137 нм
Угол О – С – О – 118 – 1250С
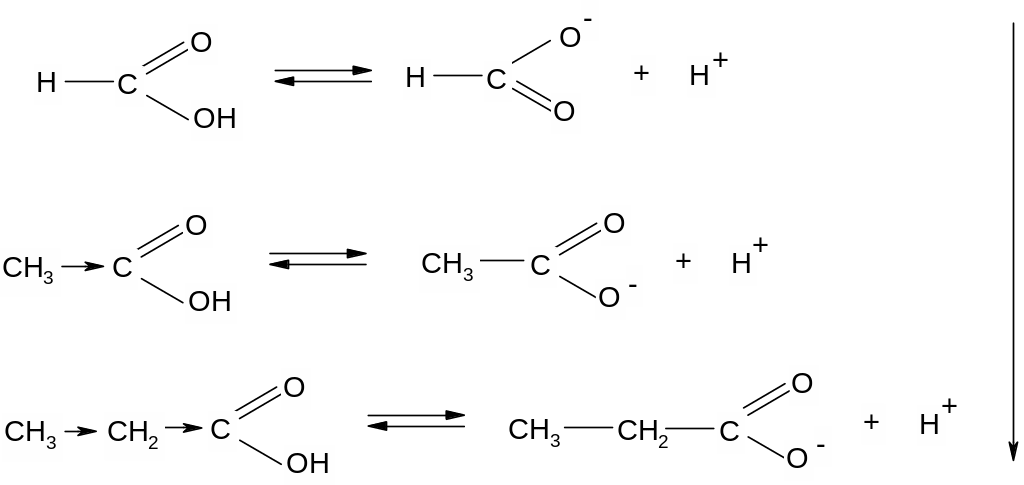
Кислотный характер карбоновых кислот. Образующийся при диссоциации карбоксилат – анион термодинамически стабилен вследствии делокализации отрицательного заряда между атомами кислорода и углерода


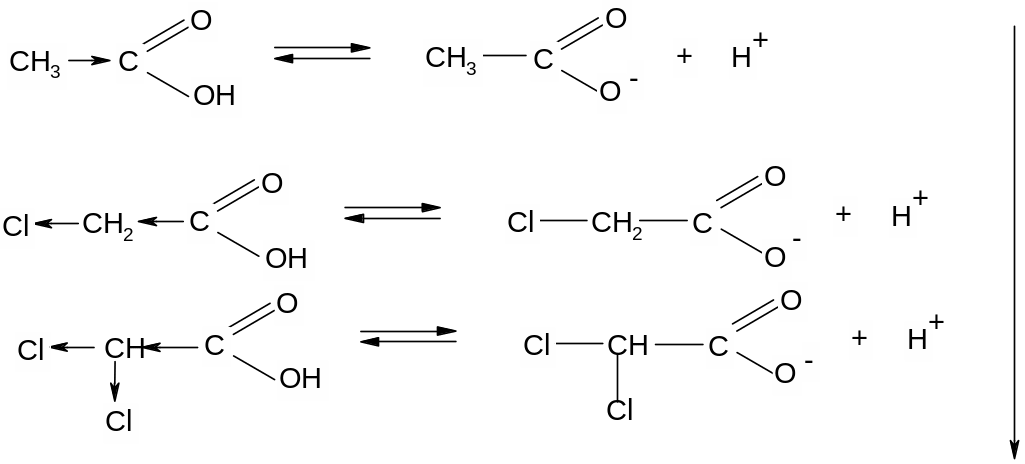
На силу кислоты оказывает влияние природа заместителя; электронодонорные заместители увеличивают электронную плотность в карбоксильной группе, дестабилизируют карбоксилат-ион и уменьшают кислотность:
Электроноакцепторные заместители уменьшают электронную плотность в карбоксильной группе, стабилизируют карбоксилат-ион и увеличивают кислотность: