
- •Лабораторно-практическое занятие №2
- •§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
- •§2 Характеристики и свойства ковалентной связи.
- •§3 Ионная связь, ее возникновение. Особенности ионной связи.
- •§4 Водородная связь; виды водородной связи.
- •§5. Индуктивный эффект.
- •§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
- •§7 Мезомерный эффект.
- •§8 Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №3
- •§1 Основные положения теории Бренстеда-Лоури и Льюиса.
- •§2. Сила кислот и оснований Бренстеда. Шкала кислотности рКа и рКв.
- •§3. Факторы, определяющие кислотность.
- •§4. Теория Льюиса.
- •§5. Экспериментальная часть
- •§6 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №4
- •§1. Алканы. Номенклатура, изомерия. Способы получения.
- •§2.Физические свойства:
- •§3. Химические свойства
- •Сульфохлорирование и сульфоокисление.
- •Дегидрирование.
- •Изомеризация.
- •§4. Циклоалканы
- •§5. Химические свойства.
- •§6. Алкены. Номенклатура, изомерия. Способы получения.
- •§7. Химические свойства
- •Гидрогалогенирование.
- •3.Гидратация
- •Присоединение серной кислоты.
- •Окисление кислородом воздуха без катализатора.
- •Окисление кислородом воздуха в присутствии серебряного катализатора.
- •Гидроксилирование.
- •Жесткое окисление.
- •V. Полимеризация.
- •§8. Экспериментальная часть
- •§9 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №5
- •§1. Алкины. Номенклатура, изомерия.
- •§2. Электронное строение
- •§3. Получение алкинов
- •§4. Физические свойства
- •§5. Химические свойства ацетиленовых углеводородов
- •§6. Алкадиены; классификация, изомерия, номенклатура. Получение диенов.
- •§7. Особенности химического строения алкадиенов с сопряженными связями
- •§8. Химические свойства
- •§9. Экспериментальная часть
- •§10. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №6
- •§1. Ароматические углеводороды. Общая характеристика,
- •§2. Физические свойства аренов. Способы получения.
- •§3. Электронное строение на примере бензола. Ароматичность;
- •§4. Химические свойства
- •§5. Понятие о многоядерных аренах. Конденсированные арены
- •§6. Химические свойства
- •§7. Экспериментальная часть
- •§8. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №7 Итоговое занятие № 1
- •Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
- •Лабораторно-практическое занятие №13
- •§1. Классификация, номенклатура, изомерия карбоновых кислот.
- •Изомерия карбоновых кислот
- •§2. Способы получения
- •§3. Физические свойства
- •§4. Химические свойства
- •§5. Применение:
- •§6. Дикарбоновые кислоты
- •§7. Способы получения
- •§8. Физические свойства
- •§9. Химические свойства
- •§10. Применение:
- •§11. Экспериментальная часть
- •§12. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №13 Тема: «Гетерофункциональные органические соединения»
- •§1. Гидроксикислоты; номенклатура, изомерия, классификация.
- •§2. Оптическая (зеркальная) изомерия молочной и винной кислот.
- •§3. Методы получения оксикислот.
- •§4. Химические свойства
- •§5. Специфические свойства гидроксикислоты
- •§6. Фенолокислоты
- •§7. Альдегидо- и кетокислоты, способы их получения
- •Кетокислоты
- •§8 Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №14 Тема: «Аминокислоты, пептиды, белки»
- •§1. Аминокислоты; строение, изомерия. Классификация.
- •§2. Способы получения аминокислот.
- •§3. Особенности строения природных аминокислот.
- •§4. Химические свойства аминокислот
- •§5. Специфические реакции аминокислот
- •§6 Образование пептидов; строение пептидной группы. Понятие о первичной структуре белка.
- •Уровня пространственной организации белковых молекул.
- •§7. Аминобензойные кислоты
- •§8. Экспериментальная часть
- •§9. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №15 Итоговое занятие № 3
§2.Физические свойства:
Метан (болотный, рудничный газ) – газ, без цвета и без запаха, с воздухом образует взрывоопасную смесь, в воде практически нерастворим.
Алканы С1 – С4 – газы, без цвета, без запаха; С5 – С15 - жидкости, без цвета, имеют слабый характерный «бензиновый» запах; высшие алканы – твердые вещества без запаха. Относительная плотность предельных углеводородов меньше единицы; они практически не растворимы в воде, но растворяются в галогенпроизводных углеводородов, простых и сложных эфирах. Температура кипения линейных алканов выше температуры кипения соответствующих разветвленных изомеров.
Электронное строение:
Атомы углерода находятся в sp³ - гибридном состоянии: в гибридизации участвуют одна s и три р-орбитали с образованием четырех sp3-гибридных орбиталей. Эти орбитали направлены к вершинам тетраэдра под углом 109,5º. Например, строение метана и этана
метан этан
Длина связи С – С в алканах составляет 0,154нм, а длина С – Н – 0,110нм.
Энергия связи С – С – 350 кДж/моль, энергия связи С – Н – 414 кДж/моль.
Молекулы н-алканов с большим числом углеродных атомов имеют зигзагообразное строение, при этом углеродные атомы находятся, с небольшими отклонениями, в одной плоскости:

В углеводородах вокруг связей С – С легко происходит вращение, поэтому существуют различные формы молекулы, отличающиеся расположением атомов в пространстве, т.е. различные конформации. Конформации различаются между собой стабильностью. Наиболее устойчивые конформации, которые фиксируются физико-химическими методами, называются конформерами.
Наиболее стабильными конформациями являются те, в которых межатомное отталкивание наименьшее. Их называют заторможенными конформациями. Конформации, в которых атомы располагаются близко, являются неустойчивыми и называются заслоненными. Различные конформации находятся в динамическом равновесии, и возможность перехода одной заторможенной конформации в другую через заслоненную конформацию, называется барьером вращения. Для изображения конформаций пользуются проекциями Ньюмена (например, конформации этана):

заторможенная заслоненная заторможенная
§3. Химические свойства
Алканы относятся к наиболее инертным в химическом отношении веществам. Причиной этого является высокая прочность σ-связей С – С и С – Н, неполярность связи С – С и низкая полярность связи С – Н . Наиболее характерными для алканов являются реакции радикального замещения. Связь С – С менее прочная, чем связь
С – Н, однако легче протекает замещение атома водорода, т.к. связь С – Н более доступна для атаки реагентом.
Реакции замещения водорода протекают по радикальному механизму и относятся к цепным процессам.
1.Галогенирование алканов. Предельные углеводороды вступают в реакции со всеми галогенами. Со свободным фтором реакция идет со взрывом. Скорость галогенирования снижается в ряду F > Cl > Br > Ι
Непосредственное взаимодействие со F2 дает углерод и НF; свободный фтор вызывает крекинг углеродной цепи, т.к. эта реакция сильно экзотермична
(∆H = - 434,5 кдж/моль) . Разбавление фтора азотом или применение растворителей способствует протеканию реакции с высокими выходами полифторпризводных – ценных химически стойких веществ:
![]()
Хлор реагирует с алканами только под влиянием света, нагревания или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
![]()
хлористый метил
![]()
хлористый метилен
![]()
хлороформ
![]()
четыреххло-
ристый углерод
Механизм радикального хлорирования метана (Н.Н.Семенов и др.):
Ι. Инициирование цепи
![]()
ΙΙ. Рост цепи
![]()
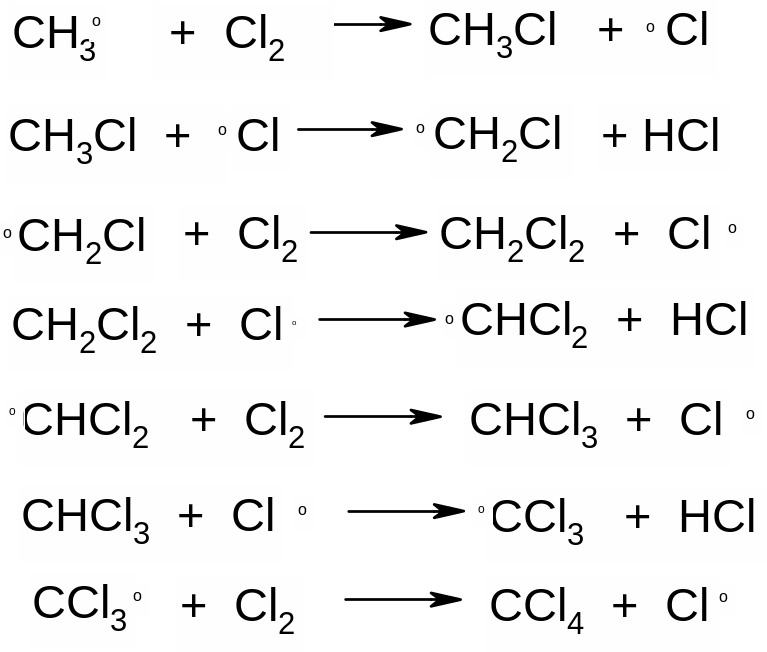
·····························································
ΙΙΙ. Обрыв цепи

Обрыв цепи происходит в результате столкновения радикалов со стенками сосуда или в результате тройного столкновения.
При хлорировании наиболее легко замещается водород у наименее гидрогенизированного (третичного) атома углерода.
Фотохимическое бромирование обычно проходит значительно более избирательно, чем хлорирование:
![]()
29% 48%
![]()
99% 1%
Очень высокая эндотермичность первой стадии роста цепи реакции иодирования алканов (129,8 кДж/моль) делает ее практически неосуществимой даже при температуре порядка 300ºС.
