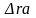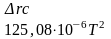- •Курсовая работа
- •Определение численных величин термодинамических функций.
- •Расчет изменения термодинамических функций по закону Гесса для стандартных условий.
- •Расчет изменения термодинамических функций по закону Гесса для стандартных условий.
- •Расчет теплового эффекта по формуле Кирхгофа.
- •Расчет изменения энтропии химической реакции с повышением температуры системы.
- •Изменение теплоемкости реакционной смеси с повышением температуры в системе.
- •Расчет эмпирической константы в уравнении Кирхгофа.
- •Расчет изменения энергии Гиббса по формуле Тёмкина-Шварцмана.
- •Расчет константы равновесия химической реакции.
- •Расчет равновесного состава реакционной смеси по закону действующих масс.
- •Расчет теплового эффекта реакции с учетом равновесной реакции алкена с соляной кислотой.
- •Расчет изменения энергии Гиббса по интегральному уравнению Гиббса-Гельмгольца.
Расчет изменения энтропии химической реакции с повышением температуры системы.
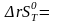

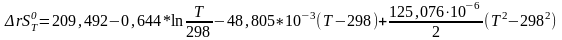
Расчет изменения энтропии химической реакции приведен в таблице 4.
Таблица 4. Расчет изменения энтропии химической реакции.
№п/п |
Т,К |
|
-0,644× |
Т-298 |
-48,81×10-3 (T-298) |
T2-2982 |
|
|
суммарн |
1 |
298 |
1 |
0,000 |
0 |
0 |
0 |
0,00 |
-400,868 |
-400,87 |
2 |
300 |
1.007 |
-0,004 |
2 |
-0,09761 |
1196 |
22,44 |
-400,868 |
-378,53 |
3 |
400 |
1.342 |
-0,190 |
102 |
-4,97811 |
71196 |
1780,98 |
-400,868 |
1374,95 |
4 |
500 |
1.678 |
-0,333 |
202 |
-9,85861 |
161196 |
5040,44 |
-400,868 |
4629,38 |
5 |
600 |
2.013 |
-0,451 |
302 |
-14,73911 |
271196 |
10176,03 |
-400,868 |
9759,98 |
6 |
700 |
2.349 |
-0,550 |
402 |
-19,61961 |
401196 |
17563,00 |
-400,868 |
17141,96 |
7 |
800 |
2.685 |
-0,636 |
502 |
-24,50011 |
551196 |
27576,56 |
-400,868 |
27150,55 |
8 |
900 |
3.020 |
-0,712 |
602 |
-29,38061 |
721196 |
40591,94 |
-400,868 |
40160,98 |
9 |
1000 |
3.356 |
-0,780 |
702 |
-34,26111 |
911196 |
56984,38 |
-400,868 |
56548,47 |

,Дж/моль*K
Т, К
Рисунок 2.Зависимость для химической реакцииот температуры.
Из рисунка 2 следует, что изменение энтропии реакционной смеси растет, так как растет степень нагретости смеси и хаотичность расположения молекул в смеси повышается.
Изменение теплоемкости реакционной смеси с повышением температуры в системе.
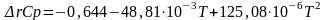
Расчет изменения теплоемкости реакционной смеси с повышением температуры в системе приведен в таблице 5.
Таблица 5. Расчет изменения теплоемкости реакционной смеси с повышением темпреатуры
Т1К |
|
|
|
|
298 |
-0,644 |
-14,545 |
11,108 |
-4,082 |
300 |
-0,644 |
-14,643 |
11,257 |
-4,029 |
400 |
-0,644 |
-19,524 |
20,013 |
-0,155 |
500 |
-0,644 |
-24,405 |
31,270 |
6,221 |
600 |
-0,644 |
-29,286 |
45,029 |
15,099 |
700 |
-0,644 |
-34,167 |
61,289 |
26,478 |
800 |
-0,644 |
-39,048 |
80,051 |
40,359 |
900 |
-0,644 |
-43,929 |
101,315 |
56,742 |
1000 |
-0,644 |
-48,810 |
125,080 |
75,626 |
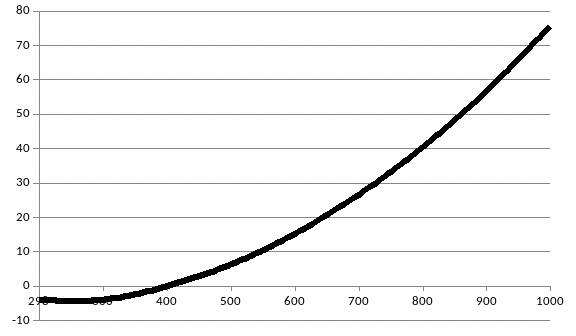
Из данных таблицы 5 видно, что изменение теплоемкости смеси повышается, при Т=450К ее изменение переходит в положительную область. Физический смысл в этом случае трудно поддается объяснению, т.к. уравнение теплоемкости является эмпирическим.
Зависимость теплоемкости реакциооной смеси от температуры отражена на рисунке 3.
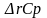 ,Дж/моль*K
,Дж/моль*K
Т, К
Рисунок 3. Зависимость = f (T) для химической реакции/


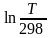

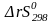 ,
,
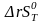 ,
,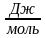 .
.