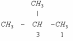- •Курсовая работа
- •Определение численных величин термодинамических функций.
- •Расчет изменения термодинамических функций по закону Гесса для стандартных условий.
- •Расчет изменения термодинамических функций по закону Гесса для стандартных условий.
- •Расчет теплового эффекта по формуле Кирхгофа.
- •Расчет изменения энтропии химической реакции с повышением температуры системы.
- •Изменение теплоемкости реакционной смеси с повышением температуры в системе.
- •Расчет эмпирической константы в уравнении Кирхгофа.
- •Расчет изменения энергии Гиббса по формуле Тёмкина-Шварцмана.
- •Расчет константы равновесия химической реакции.
- •Расчет равновесного состава реакционной смеси по закону действующих масс.
- •Расчет теплового эффекта реакции с учетом равновесной реакции алкена с соляной кислотой.
- •Расчет изменения энергии Гиббса по интегральному уравнению Гиббса-Гельмгольца.
Министерство образования и науки
"Российский государственный университет нефти и газа имени И. М. Губкина"
Кафедра физической и коллоидной химии
Курсовая работа
по термодинамике расчёта равновесного состава химической реакции в смеси с идеальными и неидеальными свойствами.
Выполнил:
Студент
Группа ХТ-11-06
Вариант
«» _______ 2013г.
Проверил:
Проф. Колесников Иван Михайлович
«______»________ 2013 г.
Москва, 2013
Определение численных величин термодинамических функций.
Химическая реакция:
CH2=CH-(CH2)4–CH3 + HCl = CH3-CHCl-(CH2)4-CH3
Таблица 1. Численные значения термодинамических функций реагентов и продуктов реакции.
Формула соединения |
Наименование |
|
Дж/моль· К |
Теплоёмкость, Дж/моль·К |
|||
|
а |
|
|
||||
H2 |
водород |
0 |
130,32 |
28,83 |
27,28 |
3,26 |
0,50 |
CH2=CH-(CH2)5–CH3 |
1-октен |
-208446 |
466,76 |
188,86 |
12,5 |
692,29 |
-383,55 |
CH3-(CH2)6-CH3 |
октан |
-20844 |
466,72 |
188,86 |
6,907 |
741,89 |
-397,27 |
Для 2-хлоргептана численные величины термодинамических функций неизвестны, и их необходимо рассчитать по эмпирическому методу образования соединений из простых веществ, например, по методу введения поправок Андерсена, Байера, Ватсона.
Расчет термодинамических
функций ∆f ,
,
и
,
,
и
 методом
введения поправок Андерсена, Байера и
Ватсона приведен в
таблице 2.
методом
введения поправок Андерсена, Байера и
Ватсона приведен в
таблице 2.
Расчет изменения термодинамических функций по закону Гесса для стандартных условий.
Для общей реакции:
ν1А
1 + ν 2А2
= ν 1А
1
+ ν12А12
1А
1
+ ν12А12
Изменение энтальпий, энтропий и теплоемкостей определяются по формулам:
 ,
,
 ,
,
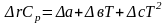 ,
,
где
 ,
,
 ,
,
.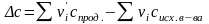
Таблица 2. Расчет термодинамических функций методом введения поправок.
№ п/п |
Порядок замещения |
Формула, после замещения |
Типовое число |
Таблица |
, Дж/моль |
, Дж/ моль К |
Теплоёмкость, Cp, Дж/моль·К |
|||||||
а |
|
|
||||||||||||
1 |
Основное вещество |
СН4 |
–– |
А |
-74851 |
186,188 |
15,857 |
69,538 |
-13,556 |
|||||
2 |
Первое замещение Н группой CH3 |
|
1––1 |
Б |
-10460 |
43,30 |
-8,368 |
90,068 |
-38,158 |
|||||
3 |
Вторичное замещение Н группой CH3 |
CH3-CH2-CH3 |
2––1 |
В |
-19874 |
42,258 |
2,050 |
92,215 |
-37,488 |
|||||
4 |
Вторичное замещение Н группой CH3 |
|
3––1 |
В |
-26401 |
23,304 |
-1,255 |
90,960 |
-36,693 |
|||||
5 |
Вторичное замещение Н группой CH3 |
CH3-CH(CH3)-CH3-CH3 |
1––2 |
В |
-20585 |
38,409 |
4,560 |
74,433 |
-27,070 |
|||||
6 |
Вторичное замещение Н группой CH3 |
CH3-CH(CH3)-CH3-CH3-CH3 |
1––2 |
В |
-20585 |
38,409 |
4,560 |
74,433 |
-27,070 |
|||||
7 |
Вторичное замещение Н группой CH3 |
CH3-CH(CH3)-CH3-CH3-CH2-CH3 |
1-2 |
B |
-20585 |
38,409 |
4,560 |
74,433 |
-27,070 |
|||||
7 |
Вторичное замещение Н группой CH3 |
CH3-CH(CH3)-CH3-CH3-CH2-CH2-CH3 |
1-2 |
В |
-20585 |
38,409 |
4,560 |
74,433 |
-27,070 |
|||||
8 |
Замещение группы СН3 на Cl |
CH3-CHCl-(CH2)4-CH3 |
|
Е |
0 |
0 |
9,162 |
-78,868 |
26,191 |
|||||
ИТОГО: |
-213926 |
209,492 |
35,686 |
561,645 |
-207,984 |
|||||||||

 Дж/моль
Дж/моль ,
,