
- •1 Билет.
- •2 Билет.
- •Эндрюс тәжірибесі
- •3 Билет.
- •5 Билет.
- •7 Билет.
- •8 Билет
- •9Билет.
- •10 Билет.
- •11 Билет.
- •12 Билет.
- •13 Билет.
- •Термодинамиканың бiрiншi заңын изопроцестерге қолдану
- •14 Билет
- •15 Билет.
- •16 Билет.
- •17 Билет.
- •Штерн тәжірбиесі
- •19 Билет.
- •20 Билет.
- •21Билет.
- •22 Билет.
- •23 Билет.
- •24 Билет.
- •25 Билет.
21Билет.
Газ заңдары.Изопроцестер
Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Идеал газ күйiнiң теңдеуiне сүйенiп изопроцестердiң негiзгi түрлерiнiң физикалық құбылыстарын қарастырайық.
1)изопроцестердің ішінен бірінші болып осы изотермиялық процесс зерттелді.
Ағылшын физигі Р. Бойль 1662 ж. және оған тәуелсіз француз физигі Э.Мариотт тәжірибе жүзінде тұрақты температура кезінде газдың берілген массасы үшін оның
қысымының газ алып тұрған көлемге көбейтіндісі тұрақты шамаға тең болатынын тағайындады.
Бұл заң Бойль Мариотт заңы деп аталады.
p 1V1 =p2V2
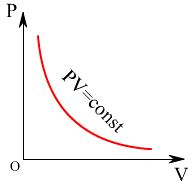
Тұрақты температурада заттың қасиетін сипаттайтын p және V шамаларының арасындағы тәуелділікті көрсететін қисық изотерма деп аталады.
Изотермалар гипербола болып табылады, процесс кезінде температура жоғары болса, графикте иперболалар да жоғары орналасады.
Қысым тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изобаралық процесс д.а
Француз
физигі Гей Люссак 1802 жылы тәжірибе
жүзінде тұрақты қысымда газдың берілген
массасы көлемінің температураға сызықты
тәуелді болатынын тағайындады, яғни
![]()
3) Көлем тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изохоралық процесс деп атайды. Егер газ герметикалық ыдыста болса, онда газ көлемi тұрақты болады.
Бұл
процесті француз физигі Ж.Шарль зерттеген.
1787 жылы ол тәжірибе жүзінде тұрақты
көлемде берілген газ массасының қысымы
оның температурасына тура пропорционал
болатынын тағайындады. Бұл заң Шарль
заңы.
Шарль өзінің заңын Гей Люссактан ерте
ашты, бірақ кеш жариялады![]() .
.

22 Билет.
Концентрация түсінігі. Қысым. Парциал қысым. Дальтон заңы.
Концентрация түсінігі. Қоспа(ерітінді,қорытпа)кұрамындағы затты компонент д.а.Қоспаның қосылыс сандық кұрамын әр түрлі тәсілдер арқ. анық.Қоспаның бірлік массасындағы не бірлік колеміндегі зат компонентерінің мөлшерін концентрация д а.ол % аныкт.ρ=m\V кг/м3 n=N/V 1/ м3 Қысым - бір дене екінші дене бетіне әсер еткенде пайда болатын қалыпты күштің (дене бетіне перпендикуляр) қарқындылығын сипаттайтын физикалық шама. Егер денеге әсер ететін күш оның бетіне біркелкі таралса, онда қысым (р) былай өрнектеледі: P=F/A не P=dF/dA Мұндағы S – дене бетінің күш түсетін бөлігінің ауданы, F – сол бөлікке перпендикуляр түсірілген күштердің қосындысы. Күш біркелкі таралған жағдайда қысым дене бетінің барлық нүктесінде бірдей болады, ал күш біркелкі таралмаса, онда қысым бір нүктеден екінші нүктеге өткен сайын өзгеріп отырады. Тыныштықтағы сұйықтықтың кез келген нүктесінің барлық бағытындағы қысымы бірдей болады. Бұл жағдай қозғалыстағы идеал (үйкеліссіз қозғалатыс) сұйық пен газ үшін де орындалады. Тұтқыр сұйықтықтың берілген нүктедегі қысымы ретінде өзара перпендикуляр үш бағыттағы (х, у, z – осьтері бағытындағы) қысымның орташа мәні р = (рх+ру+рz)/3 алынады. Газдардың кинетикалық теориясы бойынша, газды ортадағы қысым жылулық қозғалыстағы газ молекулаларының бір-бірімен, газдағы денелермен және ыдыс қабырғаларымен соқтығысуы кезінде импульстың берілуімен байланысты болғандықтан мұны “жылулық” қысым деп атайды. Ол газдың абсолют температурасы (Т) мен бірлік көлемдегі газ молекулаларының санына (n) пропорционал: р = nkT, мұндағы k = 1,38.10–23 Дж/К – Больцман тұрақтысы.
Парциал қысым. Дальтон заңы..Ыдыста бірнеше газ қоспасы болсын ж/е олардың мол.концент-сы n1,n2…ni онда мол-н жалпы концен n= n1+ n2+..+ ni=Ʃi ni .Газ қоспасының ыдыс қабырғасына түсіретін қысымы:P=nkT= n1kT+ n2kT+… nikT P1=n1 kT P2=n2 kT –парциал қысымдар деп ат. Берілген газдың парциал қысымы деп ол бастапқыда қандай мөлшерде болса,дәл сондай мөлшерде жалғыз өзі болып ыдыс қабырғасына түсіретін қысымын айтады. Мыс P1=n1 kT-қоспаға кіретін 1-газдың парц кысымы.Берілген газдың парциал қысымы деп-ол алғашында қандай мөлшерде болса,сондай мөлшерде жалгыз өзі болып,ыдыс қабырғасына түсіретін қысымын айтады..P= P1+ P2+…+=Ʃ Pi-----Дальтон заңы.
Идеал газ қоспасының қысымы оыс қоспаны құрайтын парциал қысымдардың қоспасына тең.
