
- •Пенициллины.
- •Бензилпенициллина натриевая соль.
- •Бензилпенициллина калиевая соль.
- •Бензилпенициллина новокаиновая соль.
- •Бензатинбензилпенициллин (Бициллин-1).
- •Феноксиметилпенициллин.
- •Ампициллин.
- •Оксациллина натриевая соль.
- •Карбенициллина динатриевая соль.
- •Амоксициллин.
- •Цефаллоспорины.
- •Цефалексин.
- •Цефалотина натриевая соль.
- •Ингибиторы бета-лактамаз.
- •Сульбактама натриевая соль.
КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ В-ЛАКТАМИДОВ ТИАЗОЛИДИНА И ДИГИДРОТИАЗИНА (ПЕНИЦИЛЛИНЫ И ЦЕФАЛОСПОРИНЫ)
-Лактамные антибиотики (-лактамиды) содержат в молекуле лактамный цикл.
-лактамные антибиотики:
моноциклические (природные - нокардицины и монобактамы, а также синтетические азетидиноны, в т.ч. моносульфактамы).
бициклические, в которых четырехчленный лактамный цикл сконденсирован с другим циклом по атому азота и соседнему с ним атому углерода. Вторым циклом в системе является пятичленный тиазолидиновый (пенамы), пирролидиновый (карбопенамы) или оксазолидиновый (оксапенамы) цикл, либо шестичленный дигидротиазиновый цикл (цефалоспорины и цефамицины).
К бициклическим -лактамидам относятся пенициллины (I) и сходные с ними по химической структуре цефалоспорины (II):

Механизм антибактериального действия -лактамидов состоит в блокировании конечной стадии образования стенки бактерий, которое вызывает лизис клетки. Под влиянием ферментов — лактамаз происходит процесс инактивации антибиотиков. Действие этих ингибиторов основано на конкурентном антагонизме с пенициллинами, поскольку и те и другие содержат -лактамное ядро.
При окислении атома серы тиазолидинового цикла у производных пенициллановой кислоты образуются соединения, способные подавлять -лактамазы. Примером могут служить производные 1,1-диоксида пенициллановой кислоты (III):

Широким спектром антимикробного действия и способностью ингибировать -лактамазы обладают карбапенамы (IV), продуцируемые микроорганизмами рода Streptomyces. Из оксипенамов слабой антимикробной активностью, но активной способностью подавлять многие -лактамазы обладает клавулановая кислота (V), продуцируемая Streptomyces clavuligerus.

Пенициллины.
Структурной основой природных и полусинтетических пенициллинов является 6-аминопенициллановая кислота, которая включает конденсированные тиазолидиновый (A) и лактамный (B) циклы:

Лактамный цикл впервые обнаружен в природных пенициллинах и отличается большой лабильностью к воздействию различных факторов.
Пенициллин получают путем микробиологического синтеза. Отобранные для этой цели в результате селекции промышленные штаммы плесени выделяют более 3 мг/мл бензилпенициллина за 90–120 ч ферментации, что в сотни раз больше, чем удавалось получать пенициллина из природных штаммов. В состав питательной среды обязательно входит предшественник, химическая структура которого сходна с соответствующим данному антибиотику радикалу в положении 6. В частности, при производстве бензилпенициллина предшественником служит фенилуксусная кислота или ее производные; для биосинтеза феноксиметилпенициллина — феноксиуксусная кислота и т.д.
Схема биосинтеза бензилпенициллина:

Выделение пенициллина осуществляют фильтрованием или центрифугированием. Очистку проводят способом замены растворителя.
Отделяют пенициллины друг от друга различными способами:
адсорбционной хроматографией (на активированном угле или оксиде алюминия);
распределительной хроматографией (на силикагеле)
противоточным распределением.
Кристаллические соли высокой степени чистоты получают перекристаллизацией из органических растворителей.
Особенно широко для очистки пенициллинов применяют ионообменную сорбцию.
Пенициллины за счет наличия карбоксильной группы являются кислотами, представляющими собой кристаллические вещества, очень гигроскопичные и легко инактивирующиеся. Инактивация происходит под действием кислот, щелочей и других факторов вследствие гидролиза очень лабильного в-лактамного цикла с потерей биологической активности в результате образования неактивной пенициллоиновой кислоты:
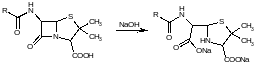
в-лактамный цикл бензилпенициллина легко разрушается под действием фермента пенициллиназы (в-лактамазы), продуцируемой многими микроорганизмами. Кроме того, многолетнее его применение привело к широкому распространению резистентных микробов. Эти обстоятельства послужили предпосылкой создания полусинтетических пенициллинов.
Синтез.
В 1957 г. Осуществлен синтез 6-аминопенициллановой кислоты (6-АПК), являющейся «ядром» пенициллина. Получают 6-АПК из бензилпенициллина (или других пенициллинов), воздействуя ферментом пенициллинацилазой, продуцируемым бактериями.

На второй стадии осуществляется ацилирование амина в молекуле 6-АПК соответствующей кислотой или ее хлорангидридом.

Биологические свойства полусинтетических пенициллинов зависят от характера заместителя в положении 6. Устойчивость к в-лактамазам обеспечивают заместители, создающие стерические препятствия разрыву в-лактамного цикла. Поэтому синтетические пенициллины с аминогруппой и карбоксилом в боковой цепи (в положении 6), как правило, обладают более широким спектром антибактериального действия, чем природные пенициллины.
Общая формула природных и полусинтетических пенициллинов:

Benzylpenicillin Sodium.
