
- •Молекулярно-кинетическая теория идеальных газов Идеальный газ.
- •Выводы основного уравнения молекулярно-кинетической теории и следствия из него
- •Средняя квадратичная скорость молекул.
- •Давление смеси идеальных газов (закон Дальтона).
- •Абсолютная температура с молекулярно-кинетической точки зрения
- •Уравнение состояния идеального газа - уравнение Менделеева-Клапейрона
- •Опытные газовые законы.
- •Задачник
- •Список литературы
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ижевский государственный технический университет имени М. Т. Калашникова»
Методические рекомендации для самостоятельной работы по теме:
"Модель идеального газа. Выводы основного уравнения молекулярно-кинетической теории и следствия из него. Молекулярно-кинетическое толкование абсолютной температуры".
Выполнил:
студент группы Б2-401-1
Яхина. Э. А.
Проверила:
Шихова О. Ф.
Ижевск, 2013
Содержание:
Молекулярно-кинетическая теория идеальных газов 2
Идеальный газ. 2
Выводы основного уравнения молекулярно-кинетической теории и следствия из него 4
Средняя квадратичная скорость молекул. 7
Давление смеси идеальных газов (закон Дальтона). 8
Абсолютная температура с молекулярно-кинетической точки зрения 8
Уравнение состояния идеального газа - уравнение Менделеева-Клапейрона 10
Опытные газовые законы. 12
Задачник 16
Список литературы 20
Молекулярно-кинетическая теория идеальных газов Идеальный газ.
Идеальный газ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объём и не взаимодействующих друг с другом на расстоянии. Молекулы непрерывно сталкиваются друг с другом и со стенками сосуда, производя на них давление. Таким образом, давление – макроскопическое проявление теплового движения молекул газа.
Важнейшей задачей кинетической теории газов является вычисление давления идеального газа на основе молекулярно-кинетических представлений.
Основные положения молекулярно-кинетической теории таковы:
1. Все тела состоят из атомов или молекул.
2. Между атомами и молекулами идеального газа нет сил взаимодействия.
3. Атомы и молекулы находятся в вечном хаотическом движении.
Существование атмосферного давления было показано рядом экспериментов в XVII веке. Одним из первых доказательств гипотезы стали магдебургские полушария, сконструированные немецким инженером Герике. Из сферы, образованной полушариями, выкачивался воздух, после чего их было трудно разъединить в силу внешнего давления воздуха. Другой эксперимент в рамках исследования природы атмосферного давления поставил Роберт Бойль. Он состоял в том, что если запаять изогнутую стеклянную трубку с короткого конца, а в длинное колено постоянно подливать ртуть, она не поднимется до верха короткого колена, поскольку воздух в трубке, сжимаясь, будет уравновешивать давление ртути на него. К 1662 году данные опыты позволили прийти к формулировке закона Бойля — Мариотта.
В 1802 году Гей-Люссаком был впервые опубликован в открытой печати закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака), однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века. Впоследствии он уточнил свои эксперименты и установил, что при изменении температуры от 0 до 100 °C объём воздуха линейно увеличивается на 0,375. Проведя аналогичные опыты с другими газами, Гей-Люссак установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
В 1834 году из комбинации этих законов Клапейрон смог составить уравнение идеального газа. Тот же закон, уже с использованием молекулярно-кинетической теории был сформулирован Августом Крёнигом в 1856 году.
Теория создана немецким физиком Р. Клаузисом в 1957 году для модели реального газа, которая называется идеальный газ. Основные признаки модели:
расстояния между молекулами велики по сравнению с их размерами;
взаимодействие между молекулами на расстоянии отсутствует;
при столкновениях молекул действуют большие силы отталкивания;
время столкновения много меньше времени свободного движения между столкновениями.
Выводы основного уравнения молекулярно-кинетической теории и следствия из него
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул.

При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ.
Рассмотрим
сферический объём радиуса R, в котором
находится N молекул идеального газа.
Рассмотрим движение одной из них.
Допустим, что молекула двигалась
прямолинейно с импульсом![]() ,
ударилась о стенку под углом ψ к нормали
и отскочила от неё под тем же углом,
имея импульс
,
ударилась о стенку под углом ψ к нормали
и отскочила от неё под тем же углом,
имея импульс![]() .
Найдём импульс, переданный молекулой
стенке при ударе. Из закона сохранения
импульса:
.
Найдём импульс, переданный молекулой
стенке при ударе. Из закона сохранения
импульса:
![]() (1)
(1)
![]() (2)
(2)
Т. к. удар упругий,
![]() и
и![]() = 0, поэтому направлен по нормали к
стенке и по модулю равен:
= 0, поэтому направлен по нормали к
стенке и по модулю равен:
![]() (3) .
(3) .
Путь, который молекула проходит от одного удара о стенку до другого, равен хорде АВ, т. е. величине 2Rcosψ.
Найдем число
ударов молекулы о стенку за одну секунду.
Оно равно отношению скорости молекулы
![]() к пути, проходимому молекулой от одного
столкновения со стенкой до другого:
к пути, проходимому молекулой от одного
столкновения со стенкой до другого:
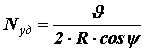 (4) .
(4) .
Сталкиваясь со стенками сосуда, одна молекула за одну секунду сообщает ей импульс
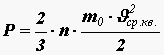 (5)
(5)
Суммарный импульс, сообщенный всеми N молекулами стенке сосуда за одну секунду, будет равен:
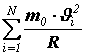 .
.
Из II закона Ньютона следует, что импульс, сообщённый за единицу времени стенке, численно равен силе, поэтому сила давления, действующая на поверхность сосуда, равна
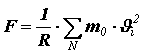 (6).
(6).
Давление найдём, разделив силу на площадь поверхности сферического сосуда:
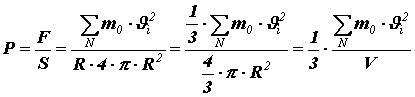 (7),
(7),
Где
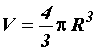 – объём сосуда с газом.
– объём сосуда с газом.
Перепишем полученное равенство в виде:
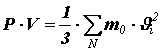 (8)
(8)
Помножив и поделив правую часть на число молекул N в объёме V, получим:
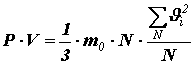 или
или
![]() (9)
(9)
Здесь введена
величина
![]() – средняя квадратичная скорость, равная
корню квадратному из суммы квадратов
всех скоростей, делённой на число
молекул:
– средняя квадратичная скорость, равная
корню квадратному из суммы квадратов
всех скоростей, делённой на число
молекул:
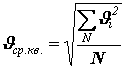 .
(10)
.
(10)
Тогда
![]() ,
(11)
,
(11)
где n![]() –концентрация молекул.
–концентрация молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Получим связь давления со средней кинетической энергией поступательного движения молекулы
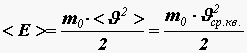 .
(12)
.
(12)
Из формулы (11)
,
следовательно:
![]() .
(13)
.
(13)
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
