
-
Основные понятия, законы химии.
Химия — наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Молекула — это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов.
Атом – это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек. Атомное ядро состоит из протонов и нейтронов, имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице.
Закон сохранения вещества отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии.
В 1808 Ж. Пруст сформулировал Закон постоянства состава, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав.
В 1803 г Д. Дальтон открыл Закон кратных отношений, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
В 1808 г Гей-Люссак сформулировал Закон объемных отношений:
«Объемы газов, вступающих в химические реакции, и объемы газов, являющихся продуктами реакции, соотносятся между собой как небольшие целые числа».
Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов).
В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что- в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого при T=273°К и p=101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm).
-
Строение электронных оболочек атомов, электрическая формула.
Главное квантовое число n определяет энергию электрона в атоме и среднее удаление электрона от ядра. n принимает целочисленные значения от 1 до ∞.
. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень. Уровень содержит строго определенное число электронов – максимально N= 2n2, где N – число электронов; n – номер уровня (считая от ядра) или главное квантовое число. (2,8,18,32).
-
Принцип Паули, принцип наименьшей энергии. Правило Гундо, Клечковского.
Принцип наименьшей энергии:
В
атоме каждый электрон располагается
так, чтобы его энергия была минимальной
(что отвечает наибольшей связи его с
ядром). Энергия электрона в основном
определяется главным квантовым числом
n и орбитальным квантовым числом l,
поэтому сначала заполняются те подуровни,
для которых сумма значений квантовых
чисел n и l является наименьшей.
Например, энергия электрона на подуровне
4sменьше, чем на подуровне 3d, так как в
первом случае n+ 1 = 4 + 0 = 4, а во втором
n +l= 3 + 2 =5; на подуровне 5s(n+l= 5 + 0 = 5)
энергия меньше, чем на 4d(n +l= 4 + 2 = 6); на
5р (n +l= 5 + 1 = 6) энергия меньше, чем на
4f(n +l= 4 + 3 = 7) и т.д. В.М. Клечковский
впервые в 1961 г. сформулировал общее
положение, гласящее, что электрон
занимает в основном состоянии уровень
не с минимальным возможным значением
n, а с наименьшим значением суммы n+l. В
том случае, когда для двух подуровней
суммы значений n и l равны, сначала
идет заполнение подуровня с меньшим
значением n. Например, на подуровнях Зd,
4р, 5sсумма значений n и l равна 5. В этом
случае происходит сначала заполнение
подуровней с меньшими значениями n, т.е.
Зd - 4р – 5sи т.д. В периодической системе
элементов Менделеева последовательность
заполнения электронами уровней и
подуровней выглядит следующим образом
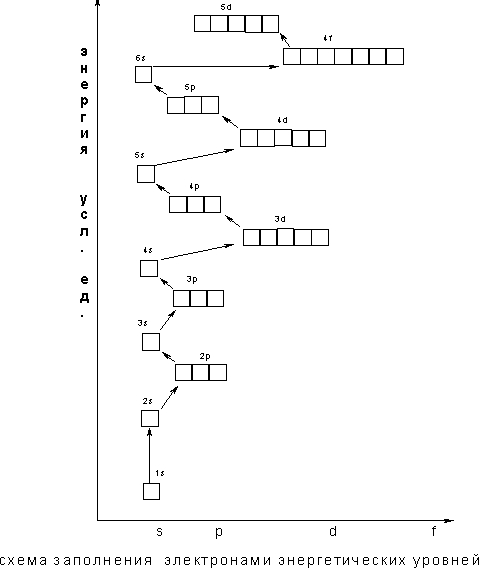
Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd.
Правило Клечковского
Заполнение энергетических подуровней происходит в порядке возрастания суммы двух квантовых чисел (п + I), а при равенстве этих сумм - в порядке возрастания п:
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p
Исключения из правила Клечковского наблюдаются для атомов элементов с полностью или наполовину заполненными d- и f -подуровнями.
Принцип Паули (принцип запрета)
В атоме не может быть двух электронов с одинаковым набором квантовых чисел.
Согласно принципу Паули, на одной орбитали, характеризуемой тремя квантовыми числами п, l, ml могут находиться только два электрона, отличающиеся значением спинового квантового числа.
На первом, состоящем из одной s-орбитали энергетическом уровне, могут находиться только два электрона, на втором уровне, включающем одну s- и три р-орбитали, могут находиться 2+6=8 электронов.
На третьем уровне, состоящем из одной s-, трех р- и пяти d-орбиталей, могут находиться 2 + 6 + 10 = 18 электронов.
На четвертом уровне максимальное число электронов равно 32.
Следствие из принципа Паули: максимально возможное число электронов на каждом энергетическом уровне равно
Nmax = 2n2.
Энергетические уровни и подуровни, которые содержат максимальное число электронов, называются завершенными или замкнутыми.
Правило Хунда
Данный энергетический подуровень электроны стремятся заполнять таким образом, чтобы суммарный спин их был максимальным.
-
Химическая связь, ее типы. Природа химической связи.
-
Строение атома.
-
Дисперсные системы.
Если в каком-то веществе (среде) распределено в виде очень мелких частиц другое вещество, то такая система называется дисперсной.
В зависимости от агрегат-о состояния вещ-ва и среды разделяют 9 типов дисп-ых систем:
-
Г+Г (O(20%)+N(78%))
-
Ж+Г (Br2+Ar)
-
Т+Г (уголь+воздух)
-
Г+Ж (кислород+вода)
-
Ж+Ж (вода+масло)
-
Т+Ж (йод+спирт)
-
Г+Т (противогаз)
-
Ж+Т (Br2 +уголь)
-
Т+Т (сплавы – серебро и платина)
-
Виды внутримолекулярных химической связи.
-
Понятие катализа, катализаторов.
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химической реакции, но сохраняющие при этом свои свойства и состав. Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Одни катализаторы ускоряют реакцию – положительный катализ, или просто катализ, другие замедляют – отрицательный катализ. Примером положительного катализа может служить получение серной кислоты из оксида. серы (IV) или окисление аммиака в азотную кислоту с помощью платинового катализатора.
Примером отрицательного катализа является замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, – ингибиторами.
Химические реакции, протекающие при участии катализаторов, называются каталитическими. Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор
– твердое вещество, а реагирующие вещества – газы или жидкость. Примером может служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния). На поверхности катализатора имеются активные центры, реагирующие вещества адсорбируются на них, происходит деформация молекул, ослабевают связи между атомами и молекулы становятся активными.
Схема действия катализатора на следующем примере:
1.Основной химический процесс:
А+ В = АВ; SO2 + ½O2 = SO3
2.Образование промежуточного соединения одного из исходных веществ с катализатором NO:
К+ В = КВ; NO + ½O2 = NO2
3.Взаимодействие промежуточного соединения со вторым исходным веществом и освобождение катализатора:
КВ + А = АВ + К; NO2 + SO2 = SO3 + NO (катализатор)
-
Химическая кинетика
Химическая кинетика — это раздел физической химии, изучающий скорость и механизм химических реакций. Кинетический метод исследования, наряду с термодинамическим и квантово-механическим, широко применяется в современном естествознании.
Химические реакции можно подразделять на два вида: гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе, например
N2
+ 3 H2![]() 2NH3.
2NH3.
Гетерогенные реакции протекают на границе раздела двух фаз, например
С (т) + O2 (г) → CO2 (г).
-
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
![]() ,
где:
,
где:
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя.
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
![]() ,
где:
,
где:
C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:
![]() ,
где:
,
где:
С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
mр-ля – масса растворителя, кг.
4. Титр – содержание вещества в граммах в 1 мл раствора:
![]() ,
где:
,
где:
T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
Vр-ра – объём раствора, мл.
5.
Мольная
доля растворённого вещества
– безразмерная величина, равная отношению
количества растворенного вещества n
к общему количеству веществ в растворе: ![]() ,
где:
,
где:
N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
-
Химическая термодинамика
Химическая термодинамика изучает энергетические эффекты химических процессов; позволяет определить возможность, направление и глубину протекания химического процесса в конкретных условиях.
Необходимо отметить, что классическая термодинамика имеет следующие
ограничения:
1.Термодинамика не рассматривает внутреннее строение тел и механизм протекающих в них процессов;
2.Классическая термодинамика изучает только макроскопические системы;
3.В термодинамике отсутствует понятие "время"
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза - совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система - система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Первое начало термодинамики представляет собой закон сохранения энергии, один из всеобщих законов природы (наряду с законами сохранения импульса,
заряда и симметрии):
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
-
Виды межмолекулярной химической связи.
-
Ковалентная связь. Это связь, образованная в результате обобществления электронных пар двумя атомами. Ковалентная связь характерна абсолютному большинству неорганических и органических соединений. Разновидностью ковалентной связи является донорно - акцепторная связь. При ней один атом представляет для образования связи пару электронов, другой атом ее принимает. Результатом взаимодействия является общая электронная пара.
-
Ионная связь. Это связь, обуславливающая электростатическое взаимодействие катионов и анионов в соединении. Возникает, если значение электроотрицательности атомов сильно отличаются. Ионная связь не направлена и не насыщаема. Например: ионная связь возникает между катионами - металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl и др.). Не существует «идеальной» ионной связи. Можно говорить лишь о большей или меньшей ионности (доля ионности).
-
Металлическая связь. Характерна только для конденсированного состояния вещества. Это многоцентровая связь с дефицитом электронов в твердом или жидком веществе, основанная на обобществлении внешних электронов атомов.
-
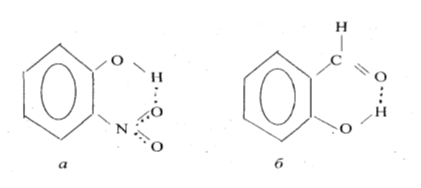
Внутримолекулярные водородные связи. Возникают в одной молекуле между атомами водорода и отрицательными атомами полярных групп. Для образования внутримолекулярных водородных связей в молекуле должны быть атомы водорода Н с выраженным положительным зарядом + (группы –O-H) и электродонорные атомы (например, =O). Например: изображены орто- нитрофенол (а) и салициловый альдегид (б), имеющие водородные связи (обозначены пунктиром) между водородом групп и кислородом других групп.
-
Периодическая система Менделеева, периодичность в изменении свойств элементов.
-
Открытие Менделеевым периодического закона.
Менделеев был глубоко убежден, что между всеми химическими эл-ми существует закономерная связь, объедин-ая их в единое целое, и пришел к заключению, что в основу систематики элементов должна быть положена их относительная атомная масса. Расположив все элементы в порядке возрастающих атомных масс, он обнаружил, что сходные в хим-ом отношении элементы встречаются через правильные интервалы и что, таким образом, в ряду элементов многие их свойства периодически повторяются. Эта закономерность получила свое выражение в периодическом законе, который Менделеев сформулировал след образом:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.»
Изменение свойств химических элементов по мере возрастания их атомной массы не совершается непрерывно в одном и том же направлении, а имеет периодический характер.
-
Предмет, задачи и значение химии.
Химия изучает состав, свойства и превращения веществ, а так же явления, которыые сопровождают эти превращения. По Менделееву, химия – учение об элементах и их соединениях. Она тесно связана с физикой, биологией, геологией, области науки и техники. Объектом изучения химии являются вещества, подразделяющие их на смеси и чистые вещества.
-
Комплексные соединения.
Комплексными называют соединения, имеющие в узлах кристаллической решетки агрегаты атомов (комплексы), способные к самостоятельному существованию в растворе и обладающие свойствами, отличными от свойств составляющих их частиц (атомов, ионов или молекул).
В молекуле комплексного соединения (например, K4[Fe(CN)6]) различают следующие структурные элементы: ион-комплексообразователь (для данного комплекса Fe), координированные вокруг него присоединенные частицы – лиганды или адденды (CN-), составляющие вместе с комплексообразователем внутреннюю координационную сферу ([Fe(CN)6]4-), и остальные частицы, входящие во внешнюю координационную сферу (K+). При растворении комплексных соединений лиганды остаются в прочной связи с ионом-комплексообразователем, образуя почти не диссоциирующий комплексный ион. Число лигандов называется координационным числом (в случае K4[Fe(CN)6] координационное число равно 6). Координационное число определяется природой центрального атома и лигандов, а также соответствует наиболее симметричной геометрической конфигурации: 2 (линейная), 4 (тетраэдрическая или квадратная) и 6 (октаэдрическая конфигурация).
-
Гидратная теория растворов. Сольваты, гидраты, кристаллы гидратов (?).
-
Энергетика химических процессов.
Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты. Так, горение, соединение металлов с серой или с хлором, нейтрализация кислот щелочами сопровождаются выделением значительных количеств теплоты. Но есть реакции, как например разложение карбоната кальция, которые требуют для своего протекания непрерывного притока теплоты извне и приостанавливаются, если нагревание прекращается.
Форма энергии, скрытая в веществах и освобождающаяся при химических, а также при некоторых физических процессах (например, при конденсации пара в жидкость или при кристаллизации жидкости), называется внутренней энергией вещества
При химических превращениях освобождается часть содержащейся в веществах энергии. Измеряя количество теплоты, выделяющееся при реакции (так называемый тепловой эффект реакции), можно судить об изменении этого запаса.
При некоторых реакциях наблюдается выделение или поглощение лучистой энергии. Обычно в тех случаях, когда при реакции выделяется свет, внутренняя энергия превращается в излучение не непосредственно, а через теплоту. Например, появление света при горении угля является следствием того, что за счет выделяющейся при реакции теплоты уголь раскаляется и начинает светиться. Но известны процессы, в ходе которых внутренняя энергия превращается в лучистую непосредственно. Эти процессы носят название холодного свечения или люминесценции.
Итак, при химических реакциях происходит взаимное превращение внутренней энергии веществ, с одной стороны, и тепловой, лучистой, электрической или механической энергии, с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими.
-
Полимеры и олигомеры.
-
Понятие энтропии и энтальпии
