
1-й семестр / Билеты с решениями 2017-18гг
.pdf
Билет 1.
1. Азот массой m=28 г адиабатически расширили в n=2 раза, а затем изобарно сжали до первоначального V. Определить изменение энтропии газа в ходе указанных процессов.
2.Работа сил в механике,Работа переменных сил,связь работы и кинетической энергии.
Тела, образующие механическую системы могут взаимодействовать как между собой, так и с телами не принадлежащими данной системе. В соответствии с этим силы, действующие на тела системы подразделяются на внутренние и внешние. Внутренние силы - это силы, с которыми на данное тело воздействуют остальные тела системы. Внешние силы - это силы, обусловленные воздействием тел не принадлежащих данной системы. В случае, если внешние силы отсутствуют система называется замкнутой. Кинетическая энергия. Если система замкнута, то есть F=0, то d(mv2/2)=0, а сама величина T=mv2/2 остаётся постоянной. Кинетическая энергия связана с работой внешних и внутренних сил. Если на частиц действует сила F, кинетическая энергия не остаётся постоянной. В этом случае, согласно утверждению d(mv2/2)=Fds, приращение кинетической энергии за время dt равно скалярному произведению Fds (ds - перемещение частицы за время ).
Величина dA= Fds называется работой силы F на пути ds (ds - это модуль перемещения). Работа результирующей всех сил, действующих на частицу идёт на приращение кинетической энергии частицы, A=t2-t1, следовательно энергия имеет такую же размерность, как и работа, в соответствии энергия измеряется в тех же единицах, что и работа.
3.Второе начало термодинамики,тепловая машина,круговые процессы(обратимые,необратимые)
Второе начало термодинамики. Невозможны такие процессы, единственным конечным результатом которых являлось бы отнятие от некоторого тела тепла и превращение этого тепла полностью в работу. Статистическое толкование второго начала термодинамики. Энтропия изолированной системы может только возрастать либо оставаться неизменной. dS?0. Энтропия в термодинамике. Сумма приведённых количеств тепла, полученных системой при переходе из одного состояния в другое не зависит от процесса, при котором это происходит, поэтому dQ/T представляет собой приращение некоторой функции состояния. Эта функция называется энтропией. dS=(dQ/T)обр. Свойства энтропии. 1. dS?dQ/T. 2. Энтропия изолированной системы может только возрастать, так как теплоизолированная система dQ=0, dS?0. 3. Для обратимых процессов dQ=0, dS=0, S=const. Статистическое толкование энтропии. 1. Энтропия изолированной системы при протекании необратимого процесса возрастает. Действительно изолированная система переходит из менее вероятных в более вероятные состояния, что сопровождается ростом величины S=k?ln?, где ? - это статистический вес, то есть количество способов, которым может быть осуществлено данное состояние. 2. Энтропия системы, находящейся в равновесном состоянии, максимальна.
Тепловой двигатель и холодильная машина. Тепловой двигатель это периодически действующий двигатель, совершающий работу за счёт поступающего из вне тепла. К.П.Д. тепловой машины это отношение совершённой работы за цикл к полученному теплу. Q1 - это количество получаемого тепла, Q2 это количество отдаваемого тепла. ?=A/Q1=(Q1-Q2)/Q1, если обратить это процесс, то получится цикл холодильной машины. Она отбирает за цикл от тела с температурой T2 количество теплоты Q2 и отдаёт телу с более высокой температурой T1 количество тепла Q1. К.П.Д. холод. машины. Холодильный коэффициент=Q2/A'=Q2/(Q1'-Q2) - работа, которая затрачивается на приведение машины в действие. К.П.Д. ?=1-(T2/T1)=(T1-T)/T1 Коэффициент полезного действия всех обратимых машин, работающих в идентичных условиях, одинаков и определяется только температурами нагревателей и холодильников. Обратимые и необратимы процессы. Обратимыми процессами называются такие процессы, которые могут быть проведены в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, только в обратной последовательности. Необратимыми процессами называются такие процессы, которые не могут проходить в обратном направлении. Круговой процесс. Круговыми процессами называются такие процессы, при которых система после ряда изменений возвращается в обратное состояние. Цикл Карно для идеального газа и его К.П.Д. Цикл Карно - это обратим цикл, соверш.веществом, вступающим в тепл. обмен с двумя тепл. резервуарами бесконечно большой ёмкости. Он состоит из двух изотерм и двух адиабат. К.П.Д. для цикла Карно ?=1-(T1/T2).
Билет 2.
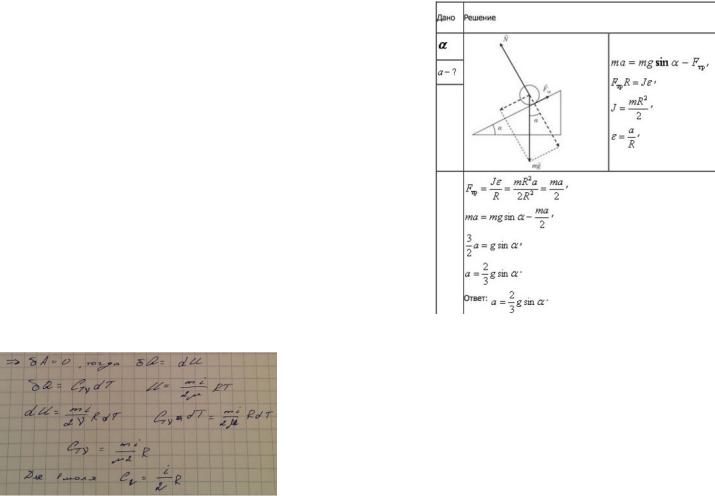
1.Сплошной однородный диск скатывается без скольжения по наклонной плоскости, образующей угол a (альфа) с горизонтом. Определить линейное ускорение а центра диска.
2.Потенциальное силовое поле. Потенциальная энергия системы.
Потенциальная энергия системы - это скалярная физическая величина, характеризующая взаимодействие тел системы (или частей тела), зависящая от взаимного расположения тел системы (или частей одного и того же тела) и от их положения во внешнем потенциальном силовом поле. Потенциальным силовым полем называется поле, которое можно описать с
помощью функции 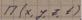 П(x,y,z,t) градиент которой
П(x,y,z,t) градиент которой
определяет силу в каждой точке поля F=  П
П
3. Применение первого начала термодинамики к изопроцессам идеального газа. Зависимость теплоемкости от вида процесса.
Изохорический. V=const =>
Изобарический. p=const =>

Изотермический. T=const =>
Билет 3.
1) Дан график теплового процесса в координатах Энтропия (x) - Температура (y) Известно, что Т изменилась в n раз. Найти КПД процесса.
2)Момент инерции. Закон Штейнера.
Момент инерции. Момент инерции - это величина равная сумме произведений всех масс на квадраты их расстояний от некоторой оси, I=сумма(mi*ri^2). Моменты инерций простейших тел. 1. Материальная точка I=mr^2. 2. Тонкий однородный стержень I=1/12ml^2, при оси проходящей через его центр масс. 3. Обруч I=mr^2. 4. Диск I=1/2mr^2. 5. Шар I=2/5mr^2. Теорема Штейнера. Момент инерции тела относительно некоторой оси равен сумме момента инерции тела относительно оси, проходящей через его центр масс и параллельной данной и произведения массы тела на квадрат расстояния между осями. I=I0+ma^2
3) Основное ур-е МКТ идеальных газов и сравнение его с формулой Менделеева-Клайперона.
Это уравнение связывает макропараметры системы – давление p и концентрацию молекул  с ее микропараметрами – массой молекул, их средним квадратом скорости или средней кинетической энергией:
с ее микропараметрами – массой молекул, их средним квадратом скорости или средней кинетической энергией:

Вывод этого уравнения основан на представлениях о том, что молекулы идеального газа подчиняются законам классической механики, а давление – это отношение усредненной по времени силы, с которой молекулы бьют по стенке, к площади стенки. Пропорциональность силы, с которой молекулы воздействуют на стенку, их концентрации, массе и скорости каждой молекулы качественно понятны. Квадратичный рост давления со скоростью связан с тем, что от скорости зависит не только сила отдельного удара, но и частота соударений молекул со стенкой. Учитывая связь между концентрацией молекул в газе и его плотностью ( = nm0), можно получить еще одну форму основного уравнения
МКТ идеального газа: 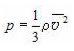
Уравнение Менделеева – Клапейрона(уравнение состояния идеального газа) В результате экспериментальных исследований многих ученых было установлено, что макропараметры реальных газов не могут изменяться независимо.
Они связаны уравнением состояния: pV = vRT где R = 8,31 Дж/(K·моль) – универсальная газовая постоянная,  , где m – масса газа и M – молярная масса газа. Уравнение Менделеева – Клапейрона называют уравнением состояния, поскольку оно связывает функциональной зависимостью параметры состояния. Его записывают и в других видах:
, где m – масса газа и M – молярная масса газа. Уравнение Менделеева – Клапейрона называют уравнением состояния, поскольку оно связывает функциональной зависимостью параметры состояния. Его записывают и в других видах:
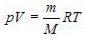
 Пользуясь уравнением состояния, можно выразить один параметр через другой и построить график первого из них, как функции второго. Графики зависимости одного параметра от другого, построенные при фиксированных температуре, объеме и давлении, называют соответственно изотермой, изохорой и изобарой. Например, зависимость давления p от температуры T при постоянном объеме V и постоянной массе m
Пользуясь уравнением состояния, можно выразить один параметр через другой и построить график первого из них, как функции второго. Графики зависимости одного параметра от другого, построенные при фиксированных температуре, объеме и давлении, называют соответственно изотермой, изохорой и изобарой. Например, зависимость давления p от температуры T при постоянном объеме V и постоянной массе m
газа – это функция 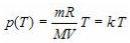 , где k – постоянный числовой множитель. Графиком такой функции в координатах p,Т будет прямая, идущая от начала координат, как и графиком функции y(x)=kx в координатах y,x (рис. 3). Зависимость давления p от объема V при постоянной массе m газа и температуре T выражается так:
, где k – постоянный числовой множитель. Графиком такой функции в координатах p,Т будет прямая, идущая от начала координат, как и графиком функции y(x)=kx в координатах y,x (рис. 3). Зависимость давления p от объема V при постоянной массе m газа и температуре T выражается так:
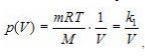 , где k1 – постоянный числовой множитель. График функции
, где k1 – постоянный числовой множитель. График функции 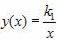 в координатах y,x
в координатах y,x
представляет собой гиперболу, так же как и график функции 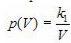 в координатах p,V.
в координатах p,V.
Билет4
1)По цилиндру массы m радиуса R, лежащему на столе, наносится короткий горизонтальный удар, сообщающий ему импульс p. Высота удара над центром равна kR(k<=1). Найти энергию поступательного и вращательного движения цилиндра. При каком k цилиндр покатится без скольжения.
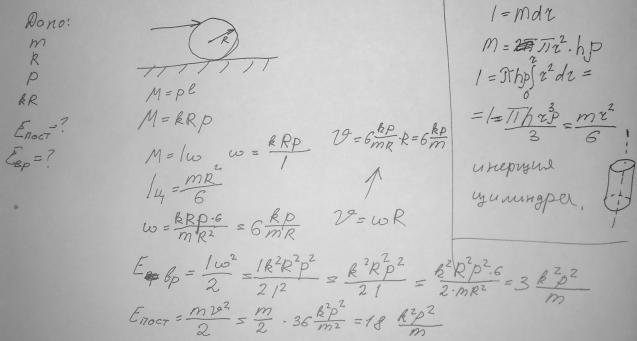
2)Закон сохранения импульса и закон сохранения энергии,как следствия из законов Ньютона. Первый закон Ньютона.
Второй закон Ньютона. Скорость изменения импульса тела равна действующей на тело силе, dp/dt=F. Третий закон Ньютона. Силы, с которой действуют друг на друга тела равны по модулю и противоположны по направлению, F12=-F21.
Законы: Всякое тело в инерциальной системе отсчёта, находящееся в состоянии покоя или равномерного движения и прямолинейного движения, пока воздействие со стороны других тел не заставит его изменить это состояние. Импульс замкнутой системы остается постоянным. Для замкнутой системы F=0,dp/dt=0.
Полная механическая энергия замкнутой системы тел, между которыми действуют только консервативные силы, остаётся постоянной. Проще говоря, при отсутствии диссипативных сил(например, сил трения) механическая энергия не возникает из ничего и не может исчезнуть в никуда.
3)Реальные газы.Уравнение Ван-дер-Ваальса.Внутренняя энергия реального газа. Реальные газы.
Поведениереальных газов хорошо описывается уравнением pVM=RT только при слабых силах межмолекулярного взаимодействия. Реальный газ- это газ, между молекулами которого существуют заметные силы межмолекулярного взаимодействия. Для описания свойств реального газа используются уравнения, отличающиеся от уравнения Клаперона-Менделеева. Уравнение Ван-дер-Вальса описывает поведение газов в широком интервале плотностей: (p+(a'/V^2))(V-b')=нюRT, a'=ню^2a, b'=нюb, где a и b - константы Ван-дер-Вальса, зависящие от газа, ? - количество молей, p - давление, оказываемое на газ извне (равное давлению газа на стенки сосуда). Изотермы реального газа. Изотермическое - это состояние, когда температура постоянна. Для этого случая, то есть для изотермической атмосферы зависимость давления от высоты равняется p=p0exp(-(Mgh)/(RT)) - это барометрическая формула. Внутренняя энергия реального газа. U=ню(Cv)T-a'/V, где a'=ню^2a. По этой формуле можно находить приближенное значение внутренней энергии реальных газов.
Билет5
1)Стержень массой М и длинны L, который может свободно варащаться вокруг неподвижной горизонтальной оси, проходящей через 1 из его концов, под действием Fтяжести переходит из горизонтального положения в вертикальное. Проходя через вертикальное положение, нижний конец стержня упруго ударяется о тело массы m, лежащее на гладком столе. Определить скорость тела m после удара. На кокое S переместится тело m после удара, если Ктр.=мю. Стержень сразу после удара остановился.
Центр масс стержня переместился на l/2.
Изменение потенциальной энергии привело к увеличению кинетической энергии центра масс: Mv^2/2 и к увеличению

кинетической энергии вращения Jw^2/2
Момент инерции стержня при таком вращении: J=Ml^2/3. Угловая скорость и скорость ц. м связаны так: v=wl/2.
Подставляем: Mgl/2=Mw^2l^2/8+Ml^2w^2/6 g=w^2l(1/8+1/6)
w=V(24g/(7l))
Линейная скорость конца стержня равна u=V(24gl/7)
Осталось записать два уравнения сохранения при абсолютно упругом ударе: 0+Mu=mv2+Mu2 - импульс
0+Mgl/2=m(v2)^2/2+M(u2)^2/2
Из первого уравнения выражаем u2 и подставляем во второе. Находим v2 - скорость тела после удара
2)материальная точка,радиус вектор,скорость,ускорение,линейная скорость,угловая скорость,угловое ускорение..
3)распределения Максвелла и про квадратичную,среднюю скорости молекул.
Умножим левую и правую часть основного уравнения молекулярно-кинетической теории 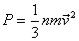 на объем одного моля газа
на объем одного моля газа
Отсюда можно получить среднюю квадратичную скорость молекул, которая приписывается газовым молекулам, чтобы объяснить производимое ими давление.
Действительно, в этом уравнении величины Р и V легко измеримы, величины же NA и m, хотя и неизмеримы непосредственно в отдельности, но произведение их, входящее в формулу, представляет собой численно молекулярную массу.
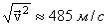
Подсчитаем среднюю квадратичную скорость молекул воздуха при нормальных условиях:
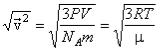 .
.
Принимая для воздуха µ = 29  , получим
, получим

Билет 6.
1)Однородный цилиндр массы М может вращаться без трения вокруг горизонтальной оси. На тонкой нерастяжимой нити, намотанной на цилиндр, прикреплены два одинаковых груза массой m каждый. Определить натяжение нити.
2) Законы сохранения импульса и механической энергии как следствия законов Ньютона
Второй закон Ньютона. Скорость изменения импульса тела равна действующей на тело силе, dp/dt=F. Третий закон Ньютона. Силы, с которой действуют друг на друга тела равны по модулю и противоположны по направлению, F12=-F21.
Законы: Всякое тело в инерциальной системе отсчёта, находящееся в состоянии покоя или равномерного движения и прямолинейного движения, пока воздействие со стороны других тел не заставит его изменить это состояние. Импульс замкнутой системы остается постоянным. Для замкнутой системы F=0,dp/dt=0.
Полная механическая энергия замкнутой системы тел, между которыми действуют только консервативные силы, остаётся постоянной. Проще говоря, при отсутствии диссипативных сил(например, сил трения) механическая энергия не возникает из ничего и не может исчезнуть в никуда.
3) Теплоемкость идеального газа. Связь теплоемкости при постоянном давлении и постоянном объеме.
Теплоёмкостью какого либо тела называется величина равная количеству тепла, необходимого для того, чтобы изменить температуру тела на 1К. C тела=d'Q/dT (Джуль/К). Теплоёмкость моля вещества называется молярной теплоёмкостью Cм (Джоуль/(Моль×К)). Теплоёмкость единицы массы вещества называется удельной теплоёмкостью с (Джоуль/(кг×К)). c=C/M. Величина теплоёмкости зависит от условий, при которых происходит нагревание тела.
1.При постоянном объёме Cv=dUм/dT.
2.При постоянном давлении Cp=dUм/dT+p(∂Vм/∂T) ; Cp=Cv+p(∂Vм/∂T); (∂Vм/∂T)=R/p. Cp=Cv+R. Cp=(i/2)(R/M); Cp=((i+2)/2)(R/M). Формула Майера. Cp-Cv=R из формулы Майера видно, что работа, которую совершает моль идеального газа при повышении его температуры на 1 К при постоянном давлении оказывается равной газовой

постоянной R.
Билет 7 1)Определить показатель адиабаты для газовой смеси,
состоящей из 2,0 г водорода и 8,0 г гелия. Газы идеальные.
2) Потенциальная и кинетическая энергия механической системы. Закон сохранения механической энергии.
Потенциальная энергия (Ер) - энергия, которой обладает толо вследствие своего движения и которое является мерой механического движения тела, зависящей от скорости его движения в данной системе отсчета.
Кинетическая энергия (Ек)— скалярная функция, являющаяся мерой движения материальной точки и зависящая только от массы и модуля скорости материальных точек, образующих рассматриваемую физическую систему, энергия механической системы, зависящая от скоростей движения её точек в выбранной системе отсчёта.
Если тела, составляющие замкнутую механическую систему, взаимодействуют между собой только посредством сил тяготения и упругости, то работа этих сил равна изменению потенциальной энергии тел,
взятому с противоположным знаком: A = –(E – E )
р2 р1
По теореме о кинетической энергии эта работа равна изменению кинетической энергии тел
Следовательно 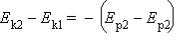 или Ek1 + Ep1 = Ek2 + Ep2.
или Ek1 + Ep1 = Ek2 + Ep2.
Сумма кинетической и потенциальной энергии тел, составляющих замкнутую систему и взаимодействующих между собой посредством сил тяготения и сил упругости, остается неизменной.
Это утверждение выражает закон сохранения энергии в механических процессах. Он является следствием законов Ньютона. Сумму E = Ek + Ep называют полной механической энергией. Закон сохранения механической энергии выполняется только тогда, когда тела в замкнутой системе взаимодействуют между собой консервативными силами, то есть силами, для которых можно ввести понятие потенциальной энергии.
3) Второе начало термодинамики. Энтропия идеального газа
Второе начало термодинамики. Невозможны такие процессы, единственным конечным результатом которых являлось бы отнятие от некоторого тела тепла и превращение этого тепла полностью в работу.Статистическое толкование второго начала термодинамики. Энтропия изолированной системы может только возрастать либо оставаться неизменной. dS³0. Энтропия в термодинамике. Сумма приведённых количеств тепла, полученных системой при переходе из одного состояния в другое не зависит от процесса, при котором это происходит, поэтому dQ/T представляет собой приращение некоторой функции состояния. Эта функция называется энтропией. dS=(dQ/T)обр. Свойства энтропии. 1. dS³dQ/T. 2. Энтропия изолированной системы может только возрастать, так как теплоизолированная система dQ=0, dS³0. 3. Для обратимых процессов dQ=0, dS=0, S=const.Статистическое толкование

энтропии. 1. Энтропия изолированной системы при протекании необратимого процесса возрастает. Действительно изолированная система переходит из менее вероятных в более вероятные состояния, что сопровождается ростом величины S=k×lnW, где W - это статистический вес, то есть количество способов, которым может быть осуществлено данное состояние. 2. Энтропия системы, находящейся в равновесном состоянии, максимальна.
Найдем выражение для энтропии идеального газа. Поскольку энтропия аддитивна, достаточно найти ее значение для киломоля
газа |
. Энтропия произвольной массы газа т будет равна |
|
Будем исходить из уравнения (96.4) первого начала термодинамики, подставив в него выражение |
для идеального газа: |
|
Разделив 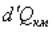 на Т, получим dSкм(см. (133.5); процесс предполагается обратимым):
на Т, получим dSкм(см. (133.5); процесс предполагается обратимым):
(136.1)
В соответствии с уравнением состояния идеального газа p/Tравно R/V . Следовательно, (136.1) можно записать так:
км
Взяв от dS неопределенный интеграл, получим:
км
(136.2)
где S — постоянная интегрирования. Формула (136.2) дает выражение энтропии киломоля идеального газа в переменных Т и V.
0км
С помощью уравнения состояния можно перейти к выражениям Sкм в других переменных. Подставив в (136.2) Vкм=RT/p получим:
|
|
|
Обозначив RlnR+S0км через |
и учитывая, что для идеального газа Cv+R равно Cp, можно написать: |
|
(136.3)
Наконец, заменяя в (136.2) Т через pVкм/R,можно получить:
(136.4)
где
