
- •Оглавление
- •Конференция урфу и мисис
- •История развития «Сатурна»: свинец в химической науке
- •Промышленная революция – скачкообразный или эволюционный процесс?
- •История развития зенитного вооружения на примере предприятия «окб «новатор»
- •Железо в строительстве
- •Лженауки и их роль в развитии научного знания
- •Развитие каталитической химии
- •История металлургии мышьяка
- •Современные аспекты математического моделирования
- •Европейское Просвещение и философская антропология ж.-ж. Руссо
- •Исторический путь страны, общественный идеал и самобытность России
- •Техническая сущность изобретения Гуттенберга
- •Коррозионно-стойкие стали с повышенным содержанием азота
- •Металлургия титана
- •Большевистский проект модернизации России: прогнозы и.А.Ильина и г.П.Федотова
- •Идеология Модернизации России: либеральный проект 1990-х и современные перспективы
- •Исторические этапы развития атомной энергетики россии
- •Роль металлургических технологий в формировании современного костюма
- •Великие китайские изобретения
- •Алхимия как прародитель современной химии: взгляд в прошлое
- •История науки и техники и университетское образование
- •620002, Екатеринбург, ул. Мира, 19
- •620002, Екатеринбург, ул. Мира, 17, оф. 123
Развитие каталитической химии
На дороги ежедневно выезжают миллионы автомобилей, и каждый – источник загрязнения воздуха. Особенно это чувствуется в крупных городах, где выхлопные газы автомобилей могут создавать большие проблемы. Для решения этих проблем каждая страна издает свои законы, которые ограничивают допустимый уровень загрязнения, который может создавать каждая машина. В 1975 г. произошло одно из значительных изменений в конструкции автомобильного двигателя и топливных систем, называемое каталитическим преобразователем (конвертером) или просто катализатором. Работа каталитического преобразователя заключается в преобразовании вредных выхлопных газов в менее вредные прежде, чем они покинут выхлопную систему автомобиля[1].
Катализ – универсальное и очень разнообразное явление, широко распространенное в природе и используемое человечеством за тысячи лет до осознания сути каталитических процессов. Катализ в переводе с греческого означает (κατάλυσις восходит к καταλύειν – разрушение) – избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий[2, С.9].
Согласно Советской энциклопедии катализатор – это химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[3, С.335]. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Определение, данное составителями энциклопедии, включает два существенных момента: катализатор входит в состав промежуточных соединений, но не фигурирует в стехиометрическом уравнении основной реакции и, следовательно, не влияет на равновесие основной реакции и не расходуется в ней. Катализатор за счет участия в образовании интермедиатов обеспечивает протекание реакции по другому пути, имеющему более низкую наблюдаемую энергию активации, и значит более высокую скорость превращения реагентов в продукты (рисунок 1).
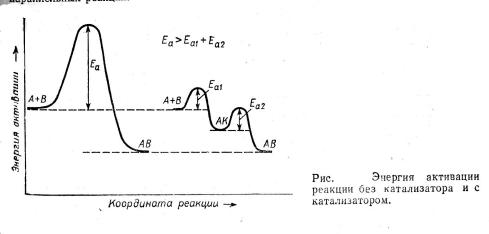

Рисунок 1. Энергия активации реакции без катализатора (а) и с катализатором(б)
Боресков Г.К. в своих работах в 1968 г. написал: «Когда-то катализ рассматривался как особое, немного таинственное явление, со специфическими законами, раскрытие которых должно было сразу в общей форме решить задачу подбора. Сейчас мы знаем, что это не так. Катализ по своей сущности – химическое явление. Изменение скорости реакции при каталитическом воздействии обусловлено промежуточным химическим взаимодействием реагирующих веществ с катализатором»[4].
Химический (небиологический) катализ принято делить на гомогенный и гетерогенный. Гомогенный катализ – это такой процесс, протекающий в одной фазе, в которой находятся реагенты и катализатор. Гетерогенный катализ – это процесс, в котором катализатор – твердое вещество, а реагенты могут быть жидкими или газообразными. С участием гомогенных катализаторов протекают гомогенно-каталитические процессы, а с участием гетерогенных – гетерогенно-каталитические. Эту классификацию нельзя путать с классификацией реакционных систем по фазности (гомофазные – одна фаза, гетерофазные – несколько фаз и есть границы раздела фаз). Системы, в которых протекают гомогенно-каталитические процессы могут быть как гомофазными, так и гетерофазными.
Основные определения катализа находятся в химической энциклопедии[3] и книге Шмидта Ф.К.[2]. В книгах Левченкова С.И.[5], Волкова В.А.[7] и на сайте кафедры физической и коллоидной химии Южного Федерального Университета[6] описаны основные этапы развития химии как науки, дана информация о жизнедеятельности выдающихся ученых. В трудах Лолузктова Р.А.[11], Кэлдера Н.[10], Капицы П.Л.[9], Миронова А.Ф. в Соровском образовательном журнале[12] приводятся примеры использования катализаторов для охраны окружающей среды, в биосфере и современной химии.
Представления о катализе, как о процессе ускорения химических реакций с использованием катализатора, который представляет собой некий «пятый элемент». Основа этого учения изложена у древнегреческого философа Платона (428–348 гг. до н.э.)[5, С.12]. Платон объяснял свойства видов материи – твёрдость, плавкость, воздухообразность, огнеобразность – геометрией многогранников. Греческими геометрами было доказано, что существует лишь пять правильных многогранников: тетраэдр, октаэдр, куб, икосаэдр и додекаэдр. Поскольку из существующих видов материи самым устойчивым и наименее подвижным является Земля, то ей соответствует четырехугольная плоскость куба (рисунок 2в) как наиболее обеспечивающая эту устойчивость. Свойство других видов материи обеспечиваются соответствующими многогранниками: огню соответствует тетраэдр (рисунок 2а), воде – октаэдр (рисунок 2б), воздуху – икосаэдр (рисунок 2г). Поскольку не было элемента, соответствующего додекаэдру (рисунок 2д), Платон высказал идею, что существует еще пятый элемент, который бог использовал, чтобы создать небесные тела.
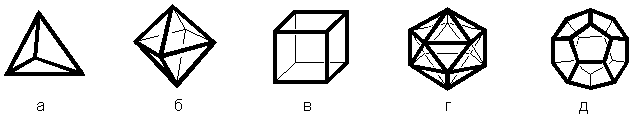
Рисунок 2. Геометрия многогранников
Данное предположение о существовании пятого элемента было сделано также греческим философом Аристотелем (384–322 гг. до н.э.) (лат. quinta essentia; эфир или начало движения), из которого состоят небесные тела. Поскольку небесам присущи вечность и совершенство, они не могут быть образованы теми же элементами, что и земные тела (тела «подлунного мира»).
Аристотель предложил схему, которая представляет собой систему четырёх стихий. По мнению Аристотеля, четыре известные стихии не материальны, а являются лишь различными проявлениями (состояниями) первоматерии (рисунок 3).

Рисунок 3. Система четырех стихий Аристотеля
Первоматерия предстаёт человеку, проявляя одновременно два из двух пар противоположных свойств – холода или тепла и влажности или сухости:
Тепло + сухость = огонь Тепло + влажность = воздух
Холод + сухость = земля Холод + влажность = вода
Таким образом, можно предположить, что начало появления идеи катализатора произошло еще в предалхимический период, с появлением «пятого элемента», способного создать другие вещества. Она коренится в элементаризме – учении о первичных элементах, а также является основой античной натурфилософии[5, С.14].
Теоретической основой арабской алхимии стало учение Аристотеля и его идея о взаимопревращаемости элементов, трансмутации. Трансмутация (лат. trans – сквозь, через, за; лат. mutatio – изменение, перемена) – превращение одного объекта в другой; обычно подразумевалось превращение несовершенных металлов в совершенные. Осуществление трансмутации являлось главной целью алхимии, для достижения которой велись поиски философского камня, который должен был выполнять такую функцию в задаче трансмутации металлов, которую мы сегодня назвали бы функцией катализатора. Но в тот период сама идея катализатора имела специфичные черты, присущие алхимии[6].
Абу Муса Джабир ибн Хайан (721-815) – знаменитый арабский алхимик, врач, фармацевт, математик и астроном, известный под латинизированным именем Гебер, разработал ртутно-серную теорию происхождения металлов, призванную объяснять свойства металлов (в частности, такие, как блеск, ковкость, горючесть) и обосновывать возможность трансмутации[5, С.22].
В основе всех металлов, согласно этой теории, лежат два принципа: Ртуть (философская Ртуть) и Сера (философская Сера). Ртуть является принципом металличности, Сера – принципом горючести. Эти принципы выступают как носители определённых свойств металлов, установленных в результате экспериментального изучения действия высоких температур на металлы. На протяжении многих веков принималось, будто действие высоких температур (метод огня) есть наилучший метод для упрощения состава тела. Философская Ртуть и философская Сера не тождественны ртути и сере как конкретным веществам. Обычные ртуть и сера представляют собой своего рода свидетельства существования философских Ртути и Серы как принципов, причём принципов скорее духовных, нежели материальных. Металл ртуть, по мнению Гебера, представляет собой почти чистый принцип металличности (философская Ртуть), содержащий, тем не менее, некоторое количество принципа горючести (философской Серы).
Арабская алхимия всегда самым тесным образом была связана с медициной, которая в арабском мире была развита весьма высоко (в частности, в Багдаде ещё в VIII в. появилась первая государственная аптека), и практически все арабские алхимики были известны ещё и как врачи[5, с23]. Таким образом, свойство «эликсира» или «философского камня» ускорять «созревание» золота и серебра, что говорит о возможности назвать искомый эликсир-катализатором.
Существуют данные о первом известном нам примере небиологического каталитического процесса – синтез диэтилового эфира из спирта при участии серной кислоты, который был осуществлен в VIII в. Джабиром ибн Хайаном.
C2H5OH + HO-C2H5 → H2O + C2H5-O-C2H5
Вторично эта реакция была открыта в 1540 г. Валерием Кордусом и получила технологическое оформление в работах С.Фробениуса.
Один из первых европейских алхимиков был английский монах-францисканец Роджер Бэкон (1214-1292), написавший трактат «Зеркало Алхимии». В трактате даётся подробное описание природы металлов с точки зрения ртутно-серной теории. Р.Бэкон определял алхимию следующим образом: «Алхимия есть наука, указывающая, как приготовлять и получать некоторое средство, эликсир, которое, брошенное на металл или несовершенное вещество, делает их совершенными в момент прикосновения». По мнению Бэкона и последователей, приготовление эликсира из «первичной субстанции» должно было осуществиться в три стадии – нигредо (чёрная стадия), альбедо (белая, в результате которой получается малый эликсир, способный превращать металлы в серебро) и рубедо (красная, продуктом которой и является великий эликсир – магистерий)[5, с.26].
Для европейской алхимии в целом мистические элементы значительно более характерны, нежели для арабской. К основоположникам мистических течений часто относят испанского врача Арнальдо де Виллановы (1240-1313) и Раймунда Луллия (1235-1313). Их труды также были посвящены трансмутации. Луллий даже утверждал, будто ему удавалось получать философский камень и золото, причём особый упор делался на магических операциях, необходимых для получения желаемых результатов[6].
Главным результатом алхимического периода, помимо накопления значительного запаса знаний о веществе, стало возникновение эмпирического (опытного) подхода к изучению свойств вещества[5, с.27].
Совершенно новое понимание задач алхимии было изложено в трудах основоположников «технической химии» Ваноччо Бирингуччо (1480-1539) «О пиротехнии» и Георга Бауэра (1494-1555), более известного как Агрикола, «De Re Metallica». Сочинения этих авторов представляли собой своего рода энциклопедии, посвящённые минералогии, металлургии, горному делу, производству керамики, т.е. технологическим процессам, предполагающим химические операции с веществами. Характерной особенностью трудов представителей технической химии стало стремление к максимально ясному, полному и достоверному описанию опытных данных и технологических процессов.
Андреас Либавий (1540-1616) прославился первым в истории учебником химии «Алхимия», вышедшим в 1597 г., в котором впервые введено слово «катализ» и имело значение «разложения» или «разрушение». Он говорил о том, что главная задача алхимии состоит в служении медицине, и относил себя к иатрохимии (греч. ιατροσ – врач). Либавий считал, что трансмутация возможна, и её осуществление явится венцом науки[6].
В период становления химии как науки происходит ее полная рационализация. Химия освобождается от натурфилософских и алхимических взглядов на элементы как на носители определенных качеств. Наряду с расширением практических знаний о веществе начинает вырабатываться единый взгляд на химические процессы и в полной мере использоваться экспериментальный метод. Завершающая этот период химическая революция окончательно придает химии вид самостоятельной науки, занимающейся экспериментальным изучением состава тел[5, с.4].
Одним из следствий произошедшей во второй половине XVII в. научной революции явилось создание новой «научной» химии. Создателем научной химии традиционно считается Роберт Бойль (1627-1691). Британский учёный Роберт Бойль являлся одним из крупнейших химиков, физиков и философов своего времени. В качестве основных научных достижений Бойля в химии можно отметить основание им аналитической химии (качественный анализ), исследования свойств кислот, введение в химическую практику индикаторов, изучение плотностей жидкостей с помощью изобретённого им ареометра. Главной заслугой Бойля стала предложенная им новая система химической философии, изложенная в книге «Химик-скептик» (1661). Бойль писал: «Химики до сих пор руководствовались чересчур узкими принципами, не требовавшими особенно широкого умственного кругозора; они видели свою задачу в приготовлении лекарств, в получении и превращении металлов. Я смотрю на химию с совершенно иной точки зрения: не как врач, не как алхимик, а как должен смотреть на неё философ. Я начертал здесь план химической философии, который надеюсь выполнить и усовершенствовать своими опытами и наблюдениями»[5, с.32].
Представления Бойля об элементе как о практически неразложимом веществе (следует отметить, что тождество терминов «элемент» и «простое вещество» сохранялось до середины XIX в.) быстро получили широкое признание среди естествоиспытателей. Большое влияние на современников оказали взгляды французского химика Николя Лемери, автора широко известного учебника «Курс химии». Учебник Лемери начинался с определения предмета химии: «Химия есть искусство, учащее, как разделять различные вещества, содержащиеся в смешанных телах. Я понимаю под смешанными телами те, которые образуются в природе, а именно: минералы, растительные и животные тела»[6]. Далее Лемери перечислял «химические начала», т.е. основные составные части тел. После некоего «универсального духа» (который сам автор признаёт «несколько метафизичным»), Лемери на основании анализа посредством огня выделял пять основных материальных начал веществ: спирт (иначе «ртуть»), масло (иначе «сера»), соль, вода («флегма») и земля. Первые три начала – активные, вода и земля – пассивные. Лемери отмечал, что эти субстанции являются для нас «началами» лишь постольку, поскольку химики не смогли далее разложить эти тела; очевидно, эти «начала» могут быть в свою очередь разделены на более простые.
В XVII и XVIII вв. во время создания научных основ химии было открыто несколько каталитических реакций с участием небиологических катализаторов. Так, в 1666 г. французский химик Лефебр и Николя Лемери разработали камерный способ синтеза серной кислоты базируясь на предыдущих разработках. В XVIII в. механизм синтеза серной кислоты был изучен Никола Клеманом (1779-1842) и Шарль Бернар Дезормом (1777-1862)[6].
Период количественных законов, ознаменовавшийся открытием главных количественных закономерностей химии – стехиометрических законов, и формированием атомно-молекулярной теории, окончательно завершает превращение химии в точную науку, основанную не только на наблюдении, но и на измерении[5, с.5].
Первые научные представления о катализе возникли одновременно с развитием атомной теории строения вещества. В 1806 г., через год после того, как один из создателей современной атомистической теории Дальтон сформулировал в «Записках Манчестерского литературного и философского общества» закон кратных отношений, Клеман и Дезорм опубликовали подробные данные об ускорении процесса окисления сернистого газа в присутствии окислов азота при камерном производстве серной кислоты. Они доказали, что в реакции участвуют не только реагенты (SO2 и O2), но и оксиды азота:
NO2 + SO2 + H2O → NO + H2SO4
NO + 1/2O2 → NO2
Клеман и Дезорм указали, что оксиды азота – «только орудие для полного окисления серной кислоты», и отметили два важных принципа катализа: нестехиометричность и цикличность действия оксидов азота.
Шесть лет спустя в «Технологическом журнале» Кирхгоф изложил результаты своих наблюдений об ускоряющем действии разбавленных минеральных кислот на гидролиз крахмала до глюкозы.
В 1818 г. французский химик Луи Тенар открыл пероксид водорода H2O2 и установил каталитическое действие на него ряда твердых веществ, например, MnO2. Эти вещества вызывали разложение H2O2: 2H2O2 = 2H2O + O2↑, но сами в ходе реакции не расходовались. С тех пор данная реакция служит эталоном каталитической активности твердых веществ[7, c.427].
Через 13 лет немецкий химик Иоганн Дёберейнер с удивлением обнаружил, что мелко раздробленная платина («платиновая чернь») способна вызвать самовоспламенение водорода и превратить этиловый спирт С2Н5ОН в уксусную кислоту СН3СООН, сама при этом не теряя и не увеличивая своей массы. Механизм реакции дегидратации этилового спирта в диэтиловый эфир изучал А.Геннель в лаборатории Майкла Фарадея (1791-1867) в 1828 г.[8].
Период классической химии характеризуется стремительным развитием науки: создается периодическая система элементов, теория валентности и химического строения молекул, стереохимия, химическая термодинамика и химическая кинетика; блестящих результатов достигают прикладная неорганическая химия и органический синтез. Добивается первых успехов биологическая химия. В связи с быстрым ростом объема знаний о веществе и его свойствах начинается дифференциация химии – обособление ее отдельных направлений, приобретающих черты самостоятельных наук[5, с.5].
К середине XIX в. окончательно оформилась и начала стремительно развиваться пограничная область науки – физическая химия. Предметом изучения новой науки можно считать химический процесс – его скорость, направление, сопровождающие его тепловые явления и зависимость этих характеристик от внешних условий. Законы, описывающие химический процесс, могут иметь одинаковый вид для совершенно различных процессов. Физическая химия позволила много сделать в области катализа.
В 1834 г. немецкий физик Эйльхард Мичерлих (1794-1863) сделал первые обобщения в области каталитических реакций. Он установил, что серная кислота в реакциях этерификации играет роль не водоотнимающего средства, как было принято считать, а контакта (катализатора). Он показал схожесть между собой множества разнообразных процессов, которые вызываются присутствием различных по своей природе веществ, не претерпевающих в процессе реакции никаких изменений, объединив их термином «контактные явления»[7, c.302].
В 1835-1836 гг. Йенс Яков Берцелиус (1779-1848), шведский химик и минералог, иностранный почетный член Петербургской Академии наук (1820), один из основателей современной химии, опубликовал серию работ, также обобщающих данные явления, предложив вместо термина «контакт» термин «катализатор». Берцелиус попытался дать объяснение закономерностям каталитических процессов, например, специфичности катализаторов, выдвинув предположение о существовании некоторых каталитических сил: «Каталитическая сила… заключается в том, что благодаря одному её присутствию, а не благодаря её сродству, могут пробуждаться дремлющие при этой температуре сродства, а вследствие влияния последних элементы сложного тела перегруппировываются в других соотношениях»[5, с.45].
С Берцелиусом вступил в полемику по этому вопросу немецкий химик Юстус Либих (1803-1873), считавший предложенное понятие каталитической силы не только неверным, но вредным для развития науки. В 1839 г. Либих высказал свою точку зрения на природу катализа, предложив гипотезу молекулярных ударов, согласно которой катализатор, находясь в состоянии усиленного движения составных частей передаёт свои колебания частицам реагентов, повышая их активность. Взгляды Берцелиуса и Либиха близки тем, что оба считали взаимодействие катализатора и реагентов нестехиометрическим.
В русской школе органической химии широкое распространение приобрело стехиометрическое объяснение каталитических процессов, предложенное Германом Ивановичем Гессом (1802-1850), заключающееся в предположении, что катализатор образует с одним из реагентов промежуточное соединение постоянного состава, которое затем взаимодействует с другим реагентом, высвобождая катализатор. Александр Михайлович Бутлеров (1828-1886) и Владимир Валильевич Марковников (1837-1904) считали, что каталитические реакции не отличаются принципиально от некаталитических. Теории промежуточных соединений оказались чрезвычайно плодотворными в классическом органическом синтезе, однако они были совершенно неприменимы к гетерогенным каталитическим процессам.
Адекватное объяснение каталитическим явлениям удалось дать лишь благодаря успехам химической кинетики и химической термодинамики. В 90-х годах XIX в. немецкий химик Вильгельм Оствальд (1853-1932) опубликовал серию ставших классическими работ по катализу, в которых определил катализатор как «вещество, которое изменяет скорость реакции, не появляясь в конечном продукте реакции». Оствальд доказал, что катализаторы не изменяют состояния химического равновесия, а лишь ускоряют его достижение, заложив в своих статьях основы термодинамики и кинетики каталитических процессов. Избрав в качестве меры каталитического действия изменение константы скорости реакции, он положил начало количественным исследованиям в данной области[7, c.332].
XVIII – XIX вв. характеризуются зарождением химической промышленности. Востребованы в больших количествах в первую очередь минеральные кислоты, поэтому появляются каталитические процессы получения H2SO4 (и гомогенные, и гетерогенные), затем – процессы получения HNO3.
Огромную роль призван сыграть катализ в решении актуальнейшей проблемы – охраны окружающей среды. Химики-каталитики настойчиво работают над этой проблемой и уже добились некоторых результатов. Разработаны специальные устройства для дожигания выхлопных газов автомобилей, работающие на основе каталитического окисления вредных компонентов газов. Подобраны катализаторы и условия для обезвреживания отходящих газов химических производств. Каталитические фильтры конструируются в виде патронов, заполненных металлической сеткой или керамическими материалами с нанесенными на них каталитическими агентами; работают эти фильтры при 250-350° С.
«На всю жизнь запомнилась мне проводившаяся по Энглеру разгонка полученного конденсата, в котором уже в начале опыта бензиновая фракция составляла 67%. Мы задержались до поздней ночи, ожидая, пока наберется достаточное количество для испытания на гоночном автомобиле, однако при этом думали, что ввиду высокого выхода бензина двигатель будет работать с детонацией. Никогда не забуду своего волнения на следующее утро, когда автомобиль забрался на холм без детонации!» – эти слова принадлежат Юджину Гудри (1892-1962), выдающемуся исследователю в области практического использования катализа. Они были сказаны им на Международном конгрессе по катализу в 1957 г., через двадцать лет после того, как в результате долгого поиска был, наконец, разработан принципиально новый способ превращения тяжелых нефтяных остатков в высокооктановое моторное топливо каталитический крекинг нефти. По словам Гудри, идея использования катализа для расщепления углеводородов нефти до низкомолекулярных продуктов, обладающих более низкой температурой кипения, пришла ему в голову еще в 1927 г. Но только спустя десять лет в Полсборо (США) на нефтеочистительном заводе компании Сокони-Мобил была построена первая в мире промышленная установка каталитического крекинга с применением в качестве катализатора соединений окиси кремния и окиси алюминия (алюмосиликата). После 1937 г. в нефтяную промышленность прочно вошли каталитические способы переработки нефти, включающие в себя множество разнообразных химических процессов. К основным из относятся: расщепление углерод-углеродных связей и изомеризация первичных продуктов расщепления (крекинг); дегидрирование и изомеризация углеводородов с образованием разветвленных и ароматических молекул минг); гидрирование ненасыщенных углеводородов с повременным удалением серы и азота в виде сероводорода и аммиака (гидроочистка); введение углеводородных фрагментов в бензольное кольцо ароматических соединений (алкилирование).
До 1937 г. крекинг нефти осуществляли исключительно термическим способом: фракции нефти обрабатывали при температуре около 500°С и давлении 50-60 атм. Каталитический крекинг ведут при ~50-500°С и атмосферном давлении в присутствии бентонитовых глин или искусственно приготовленных алюмосиликатов. При этом получают более высокооктановое топливо и ароматические углеводороды, которые могут быть использованы для дальнейшей химической переработки. Примерно одну треть моторного топлива в мире получают путем крекинга. При этом следует отметить, что более четверти всей мировой химической продукции вырабатывают из разных видов продуктов химической переработки нефти.
В 1932 г. Сергеем Владимировичем Лебедевым (1913-1990) был разработан процесс получения синтетического каучука по схеме: этиловый спирт – бутадиен – полибутадиен. Каталитические реакции в этом процессе осуществляются на первой стадии - дегидрогенизации и одновременной дегидратации этилового спирта. Сейчас бутадиен и изопрен получают также путем дегидрогенизации углеводородов нормального строения на алюмохромовых катализаторах, в частности из бутана. Это позволило вовлечь в производство синтетического каучука природные ресурсы газа и газы, отходящие при переработке нефти.
В 1947 г. Мортоном разработана исключительно активная каталитическая система, известная под кодовым названием «альфин» и представляющая собой смесь аллилнатрия, изопропилата натрия и хлорида натрия. В присутствии альфина бутадиен за несколько минут полимеризуется с образованием цепей, содержащих десятки и сотни тысяч мономерных звеньев.
Катализаторы, по сути, являются основой инноваций в нефтехимии. Достаточно сказать, что 15% внутреннего валового продукта России связано с каталитическими технологиями. Катализаторы контролируют глубину переработки сырья, возможность вовлечения в этот процесс отходов, участвуют в природоохранных технологиях. Новые каталитические системы позволяют увеличить селективность процесса и уменьшить материалоемкость, оптимизировать задействованное оборудование и улучшить качество конечной продукции.
Важнейшие каталитические процессы в промышленности:
1. Первым промышленным производством, основанным на использовании катализа, явился процесс Дикона – получение хлора окислением хлористого водорода кислородом воздуха при 400' в присутствии солей Сu.
2. Получение серной кислоты – её получают при окислении SO2 кислородом в присутствии платины. Были также разработаны ванадиевые катализаторы (V2O5 нанесенный в смеси с K2SO4 на различные носители).
3. Получение азотной кислоты – окисление аммиака на платиновых сетках. Широко используют для производства удобрений, взрывчатых веществ, и других химических продуктов.
4. Получение каучука синтетического – превращением спирта в дивинил.
5. Получение моторного топлива при помощи каталитического гидрирования угля и смолы.
6. Для повышения качества бензинов используют каталитические реакции циклизации и ароматизации углеводородов на платине.
Одним из главных революционных событий в химии XX в. стало открытие Карлом Вальдемаром Циглером (1898-1973) и Джулио Наттой (1903-1979) металлокомплексного катализа полимеризации олефинов. Это открытие имело не только выдающееся научное значение, оно также привело к принципиально новому и простому пути получения одного из важнейших промышленных полимеров – полиэтилена – и синтезу неизвестных ранее кристаллических стереорегулярных полиолефинов, в частности полипропилена и др. В 1954 г. Циглер открыл комплексные (смешанные) катализаторы, состоящие из триэтилалюминия и галогенидов титана, с помощью которых им был осуществлен низкотемпературный синтез полиэтилена. В результате модификации катализаторов Натта в том же году на этой основе разработал способы полимеризации других простых ненасыщенных углеводородов и осуществил синтез стереорегулярных полимеров.
В настоящее время под термином «катализаторы Циглера–Натта» понимают широкий ряд систем, представляющих собой комплексы соединений переходных металлов (TiCl4, TiCl3, (С5Н5)2TiCl2 и др.) с алкильными производными и другими соединениями металлов I–III групп.
Важнейшей заслугой Карла Циглера было введение им в органический синтез органических соединений лития. Эти вещества оказались чрезвычайно удобными в проведении многих реакций. И в этом плане исторически важным по своим последствиям стало изучение ученым присоединения литийорганических соединений по двойным связям С=С (1928-1950). Впервые реакция присоединения металлорганического соединения по связи С=С была отработана в 1924 г. на примере взаимодействия стильбена с фенилизопропилкалием. Это вещество еще до получения литийалкилов было легкодоступным прототипом органического соединения щелочного металла. Использование катализатора привело к созданию альтернативных путей синтеза полимеров.
В
наши дни, пожалуй, трудно найти отрасль
химии, не испытавшую в теоретическом и
практическом аспектах большее или
меньшее влияние металлокомплексного
катализа. Металлокомплексный катализ
оказал большое влияние на развитие и
совершенствование таких приоритетных
областей теоретической и прикладной
химии, как полимеризация диенов и
создание стереорегулярных каучуков,
активация алканов, высокоэффективные
и селективные процессы гидрирования
непредельных соединений, гидроформилирование
и многие другие. Но, несомненно, самой
важной областью его применения в
промышленности была и остается
полимеризация непредельных углеводородов
–
![]() -олефинов,
диенов, ацетиленов и пока в меньшей
степени алленов.
-олефинов,
диенов, ацетиленов и пока в меньшей
степени алленов.
Ферменты представляют собой особую группу примерно из двух тысяч белков, ответственных за протекание всех жизненных процессов. По двум основным показателям каталитических систем - активности и избирательности – ферменты оставляют далеко позади все другие катализаторы, при этом различия могут достигать многих порядков. Это обстоятельство хорошо объясняет, почему столь многочисленны были попытки воспроизвести in vitro то, что делают ферменты in vivo.
Приведем два примера из этой области моделирования ферментов. Первый относится к синтезу систем, моделирующих окислительные ферменты. Их основным действующим началом являются порфирины - комплексные молекулы, содержащие металлы и входящие в состав гемоглобина, миоглобина, цитохромов. Напомним, как устроен гемоглобин. Он состоит из двух частей: высокомолекулярной белковой части (глобина) и порфиринового комплекса Fe2+ (гема). Макромолекула глобина имеет так называемые гемовые карманы, в которых помещаются плоские молекулы гема. Фиксация и активация молекулярного О2 происходят на атоме металла, находящегося в центре порфиринового комплекса[12].
Вклад катализа в экономику развитых стран составляет до 25% всеобщего валового продукта и в мировом масштабе исчисляется даже не миллиардами, а триллионами долларов. Продукция же собственно химических и нефтехимических производств на 80% связана с каталитическими процессами. Фактически можно сказать, что развитие каталитической химии в течение длинного исторического периода определялось вполне определенными экономическими и социальными причинами.
Список использованных источников:
http://autorelease.ru/articles/automobile/374-avtomobilnyj-katalizator-i-ego-rol-v-vyxlopnoj-sisteme.html
Шмидт Ф. К. Физико-химические основы катализа. М.: Фрактал, 2004.
Химическая энциклопедия. М.: Советская энциклопедия, 1990. Т. 2. С.335, 337.
http://chemistry.narod.ru/stati/katalyz.htm
Левченков С.И. Краткий очерк истории химии. Ростов н/Д: Изд-во Рост. ун-та, 2006. 112 с.
http://www.physchem.chimfak.rsu.ru/
Выдающиеся химики мира: Биографический справочник/ Волков ВА., Вонский Е. В., Кузнецова Г.И. М.: Высшая школа, 1991. 656с.
http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/hrono_.html#0
Капица П. Л. Эксперимент, теория, практика. М.: Наука, 1974.
Кэлдер Н. Беспокойная Земля. М.: Мир, 1975.
Лолузктов Р. А., Пих Ю. А. Динамические модели экологических систем. М.: Гидрометеоиздат, 1980.
Миронов А.Ф. Биосинтез тетрапиррольных пигментов // Соросовский Образовательный Журнал. 1998. № 7. С. 35-42.
Аспирант, кафедра металлургии тяжелых цветных металлов УрФУ Антонович Ю.Ф.
Руководитель реферата, доцент кафедры истории науки и техники УрФУ Бармин А.В.
