
- •Элементы va подгруппы.
- •Элементы iva подгруппы.
- •Физические свойства
- •Химические свойства
- •Окислительные свойства
- •Свойства кислотного оксида
- •Качественна реакция
- •Получение
- •Элементы iiia подгруппы.
- •Элементы ia подгруппы. Щелочные металлы.
- •Применение.
- •Элементы iia подгруппы.
- •Гидроксид бериллия Be(oh)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства:
Министерство образования и науки Российской Федерации
_____________________________________________________________
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Санкт-Петербургский государственный технологический институт
(технический университет)»
Кафедра Факультет 5
Курс 1
Группа 5291
Учебная дисциплина «Общая и неорганическая химия»
КОНТРОЛЬНАЯ РАБОТА № 5
Студент Личная подпись ВАРЗИН Р. А.
Руководитель Личная подпись Расшифровка подписи должность
Санкт-Петербург
2013
Элементы va подгруппы.
39. Какие степени окисления характерны для азота? В каких гибридных состояниях могут находиться валентные орбитали атома азота? Примеры соединений азота с различным типом гибридизации.
Степени окисления азота в соединениях −3, −2, −1, 0, +1, +2, +3, +4, +5.
1. Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак;
2. Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2H4 или гидразин (существует также крайне неустойчивый пернитрид водорода N2H2, диимид);
3. Соединения азота в степени окисления −1 NH2OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе;
4. Соединения азота в степени окисления +1 оксид азота (I) N2O (закись азота, веселящий газ);
5.Соединения азота в степени окисления +2 оксид азота(II) NO (монооксид азота);
6. Соединения азота в степени окисления +3 оксид азота(III) N2O3, азотистая кислота, производные аниона NO2−, трифторид азота (NF3);
7. Соединения азота в степени окисления +4 оксид азота(IV) NO2 (диоксид азота, бурый газ);
8. Соединения азота в степени окисления +5 оксид азота(V) N2O5, азотная кислота, её соли — нитраты и другие производные, а также тетрафтораммоний NF4+ и его соли.
Строение и, следовательно, свойства соединений азота определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
Тип гибридизации азота |
Электронная конфигурация |
Число гибридных орбиталей |
Валентный угол |
sp3 |
1s2 (2sp3)5 |
4 |
» 107° |
sp2 |
1s2 (2sp2)4 2p1 |
3 |
120° |
sp |
1s2 (2sp)3 2p2 |
2 |
180° |
За счет трех одноэлектронных АО азот способен к образованию трех ковалентных связей с другими атомами по обменному механизму. В этом случае азот проявляет валентность 3 и имеет неподеленную электронную пару. Такой атом азота может выступать донором пары электронов, образуя четвертую связь по донорно-акцепторному механизму. При этом азот пробретает максимальную валентность 4 (напомним, что максимальная валентность атома определяется числом его внешних атомных орбиталей; у азота их четыре – одна 2s и три 2p). Четырехвалентный азот несет на себе положительный заряд и может участвовать в образовании ионной связи (подобно иону аммония [NH4]+).
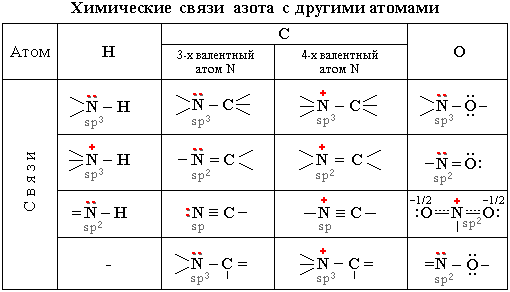
Электроотрицательности азота, водорода, углерода и кислорода равны. Поэтому связи азота с Н, С или О являются ковалентными полярными. В связях трехвалентного азота с углеродом или водородом электронная плотность смещена к более электроотрицательному атому азота, создавая на нем частичный отрицательный заряд, а на углероде или водороде – частичный положительный. В связях азота с кислородом, напротив, электронная плотность смещена от атома азота к атому кислорода, электроотрицательность которого выше. Связи с четырехвалентным азотом, несущим положительный заряд, отличаются более высокой полярностью.
