
- •Предмет химии твёрдого тела
- •2. Классификация кристаллических тел по симметрии кристаллов
- •Классификация решёток
- •3. Типы химических связей в кристаллах
- •Некоторые характеристики веществ при 298,16 к
- •4. Классификация твёрдых тел по особенностям зонной структуры
- •5. Элементы кристаллохимии твёрдых тел
- •Кубическая (гранецентрированная) (б)
- •Структуры и параметры элементарных ячеек некоторых металлов
- •Некоторые структуры с плотной упаковкой
- •Описание некоторых структурных типов
- •Типы соединений со стехиометрией ав
- •Некоторые соединения со структурой типа NaCl
- •Некоторые соединения со структурой сфалерита
- •Соединения со структурой вюртцита
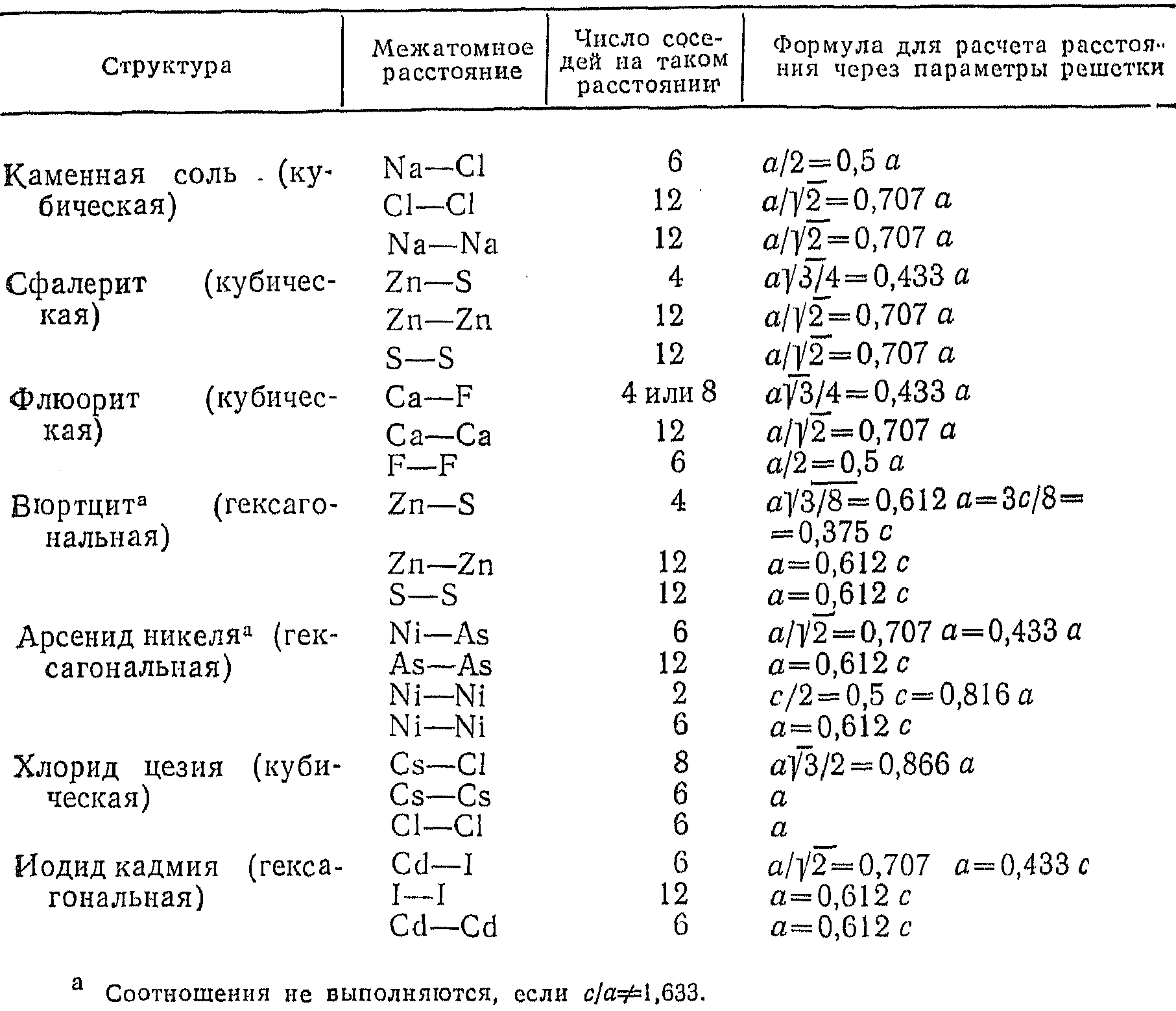
- •Расчёт межатомных расстояний в некоторых простых структурах
- •Соединения структурного типа NiAs
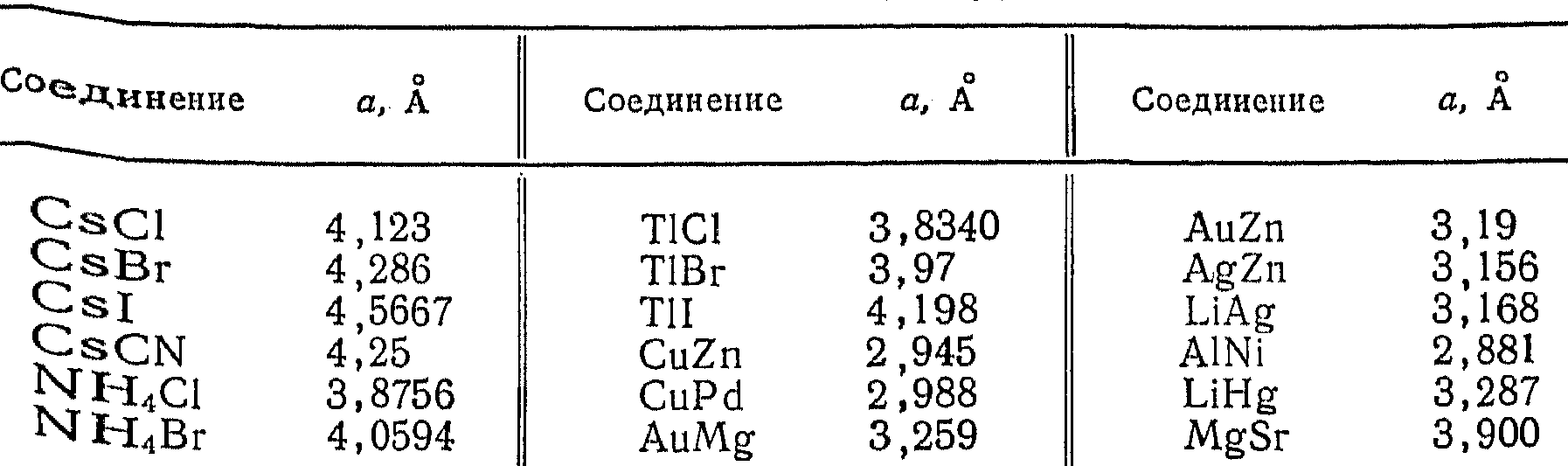
- •Соединения структурного типа CsCl
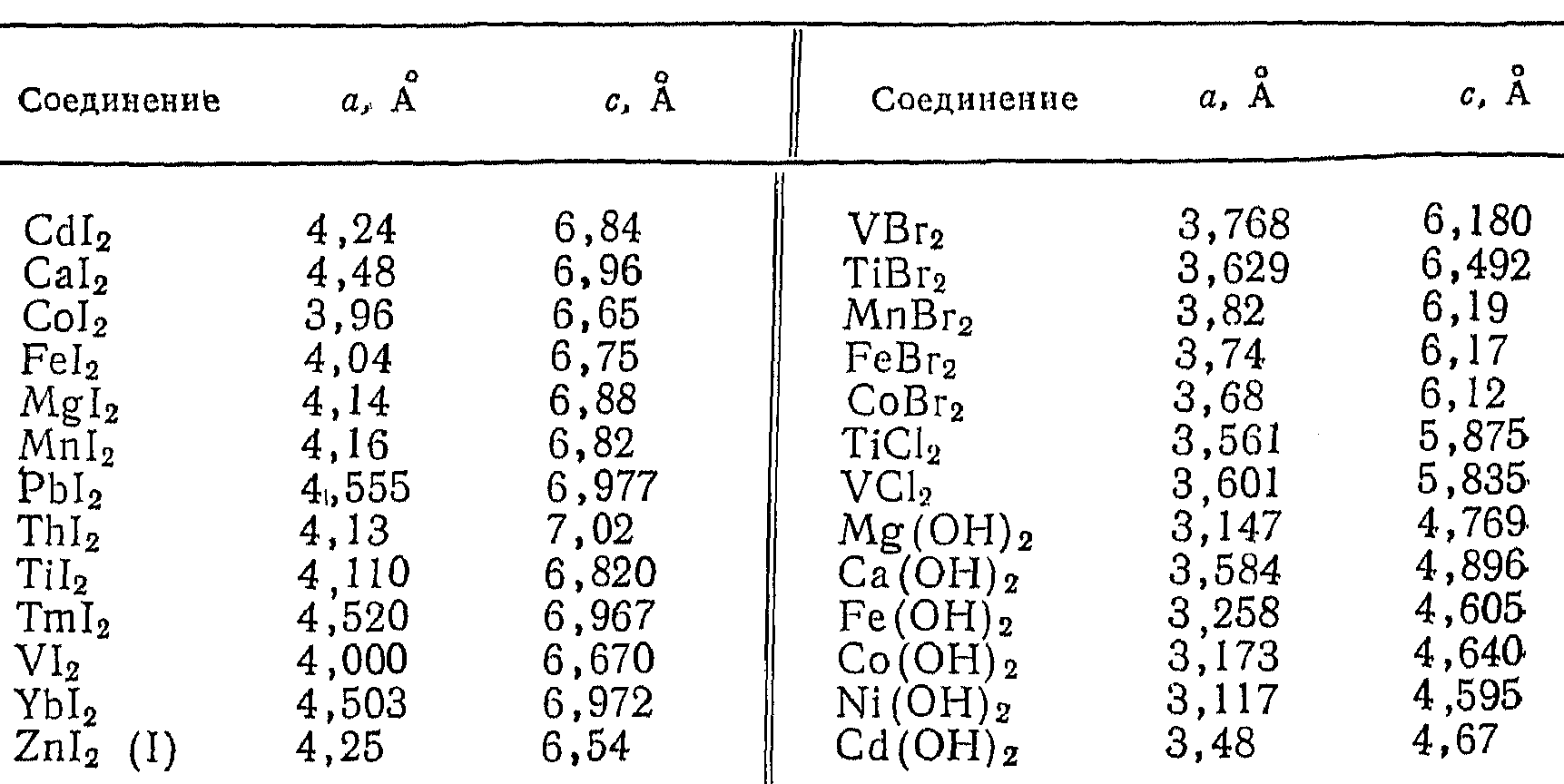
- •Соединения структурного типа CdI2
- •6. Дефекты в кристаллах
- •7. Диффузия в твёрдых телах
- •Граница раздела
- •Через границу раздела Cu/CuZn
- •8. Гетерогенные и топохические реакции
- •8.1. Реакции окисления металлов и сплавов
- •8.2. Реакции восстановления железа из его оксидов
- •8.3. Реакции образования шпинелей
- •9. Аморфные твёрдые тела – стекла
- •Национальная металлургическая академия Украины
- •Редакционно-издательский отдел нМетАу
Некоторые соединения со структурой типа NaCl
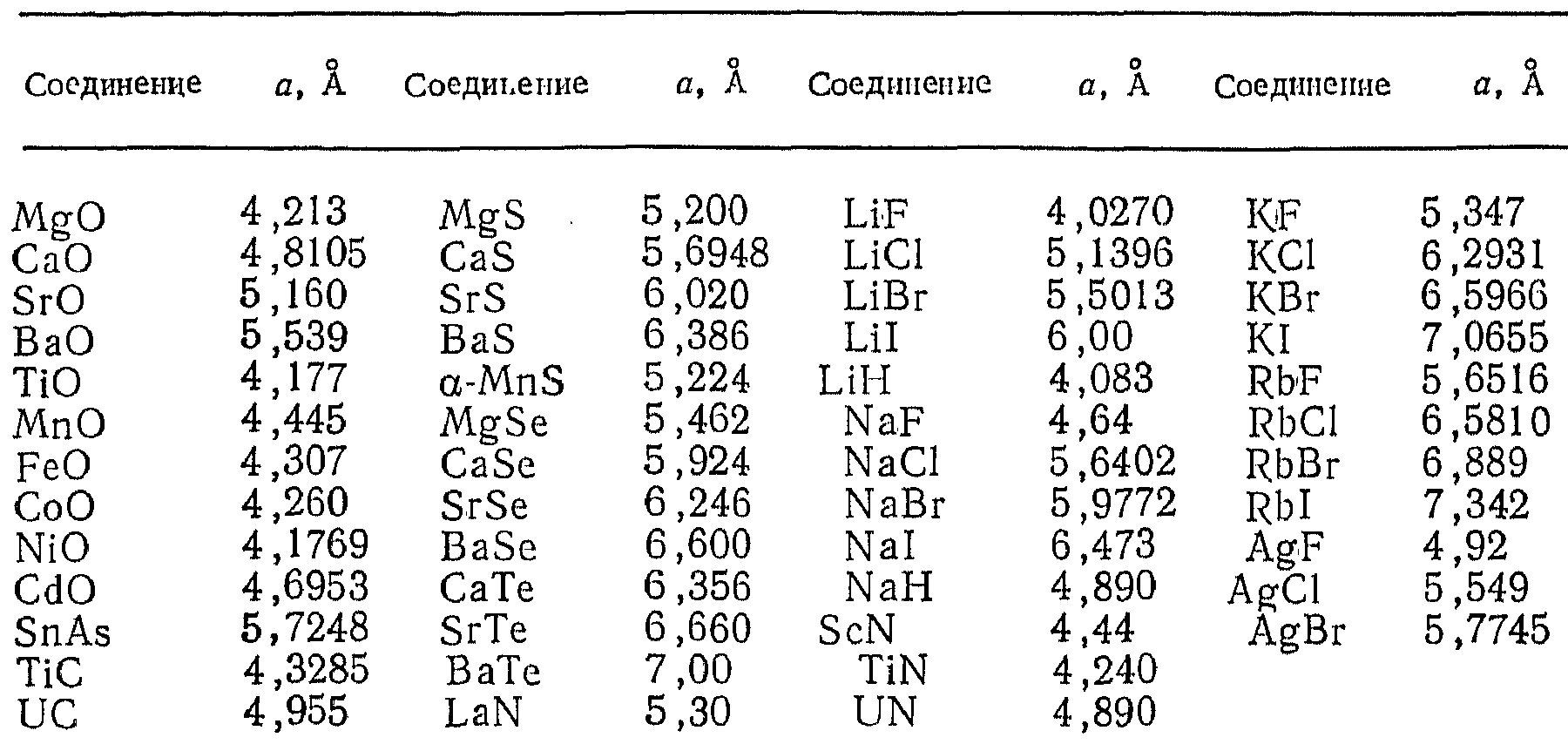
Таблица 5.5
Некоторые соединения со структурой сфалерита
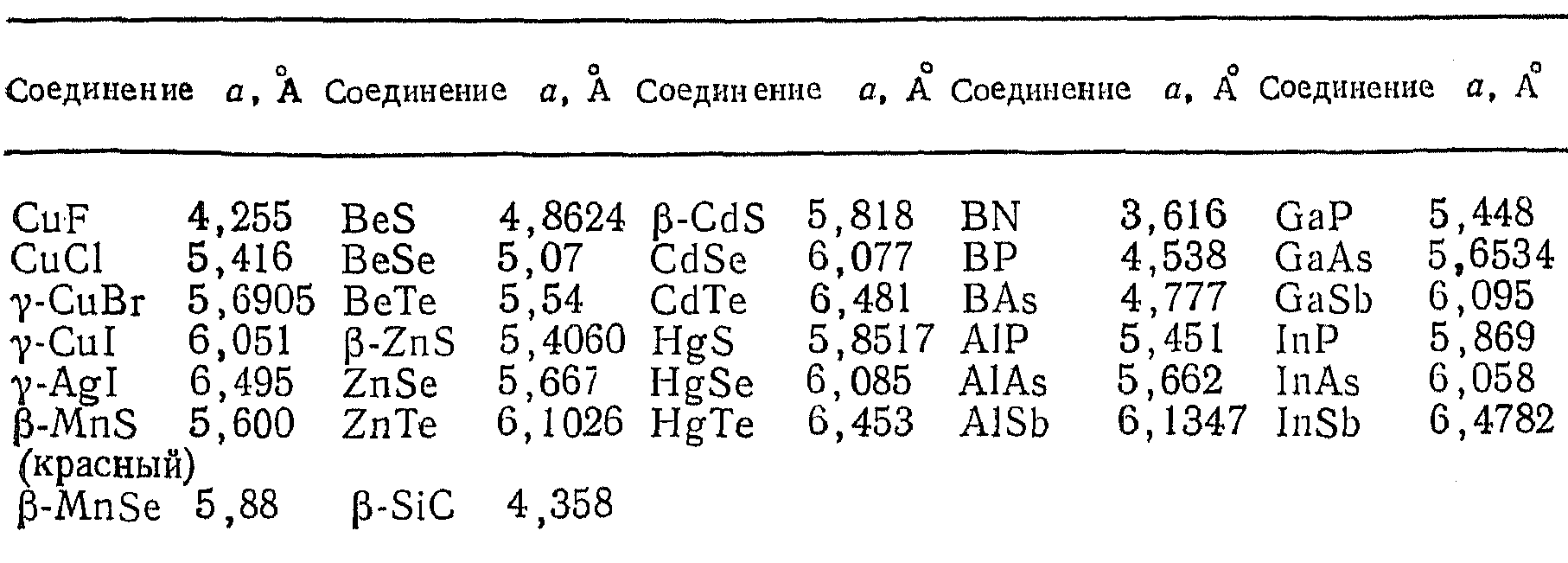
Таблица 5.6
Соединения со структурой вюртцита
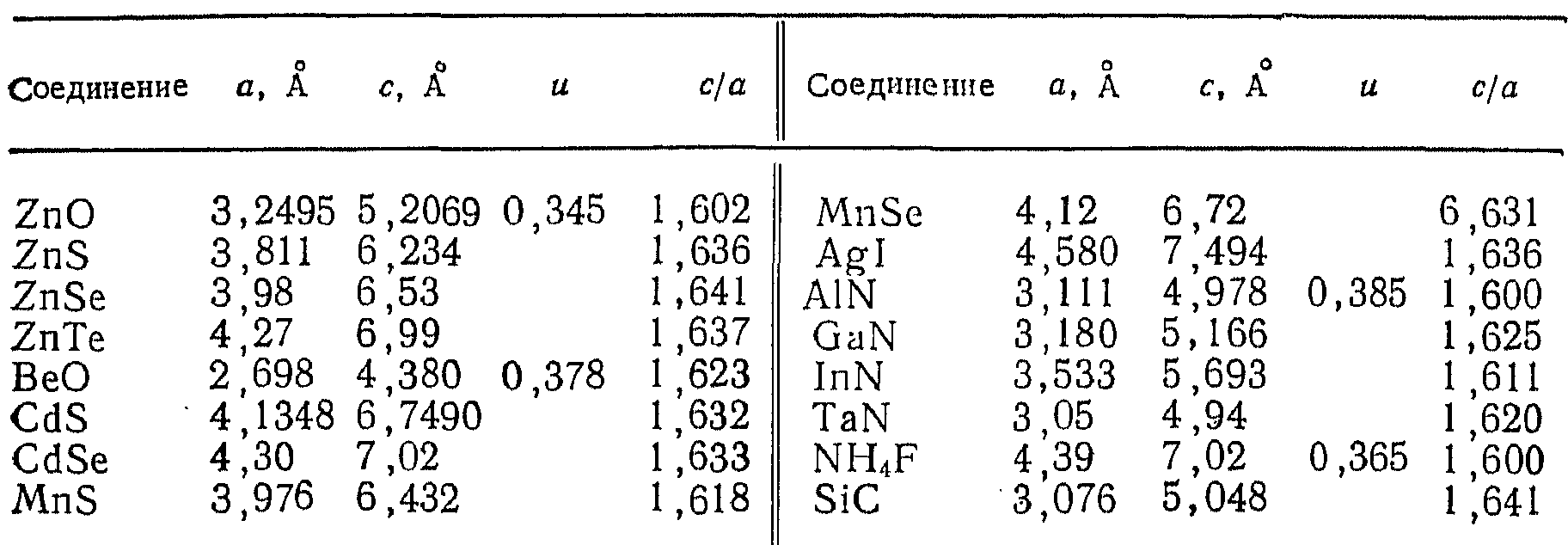
В таблице 5.6 приведены параметры элементарных ячеек соединений, кристаллизующихся в структуре вюртцита (параметр u характеризует катион-анионное расстояние в гексагональной структуре). Структура вюртцита характерна, в основном, халькогенидам некоторых двухвалентных металлов, и ее можно считать преимущественно ионной структурой
Очень часто бывает нужно найти длину связи или какое-либо другое межатомное расстояние в кристаллических структурах. Как правило, это легко сделать, в особенности для кристаллов с ортогональными элементарными ячейками (т.е. такими, в которых ά = β = γ = 900) на основе простых геометрических соображений. Например, в структуре типа NaCl максимальное катион-анионное расстояние составляет а/2, a межанионное а/√2. Используя формулы, приведенные в таблице 5.6, и данные о параметрах элементарных ячеек (например, данные таблицы 5.4), можно рассчитать межионные (межатомные) расстояния для конкретных соединений.
Таблица 5.7
Расчёт межатомных расстояний в некоторых простых структурах
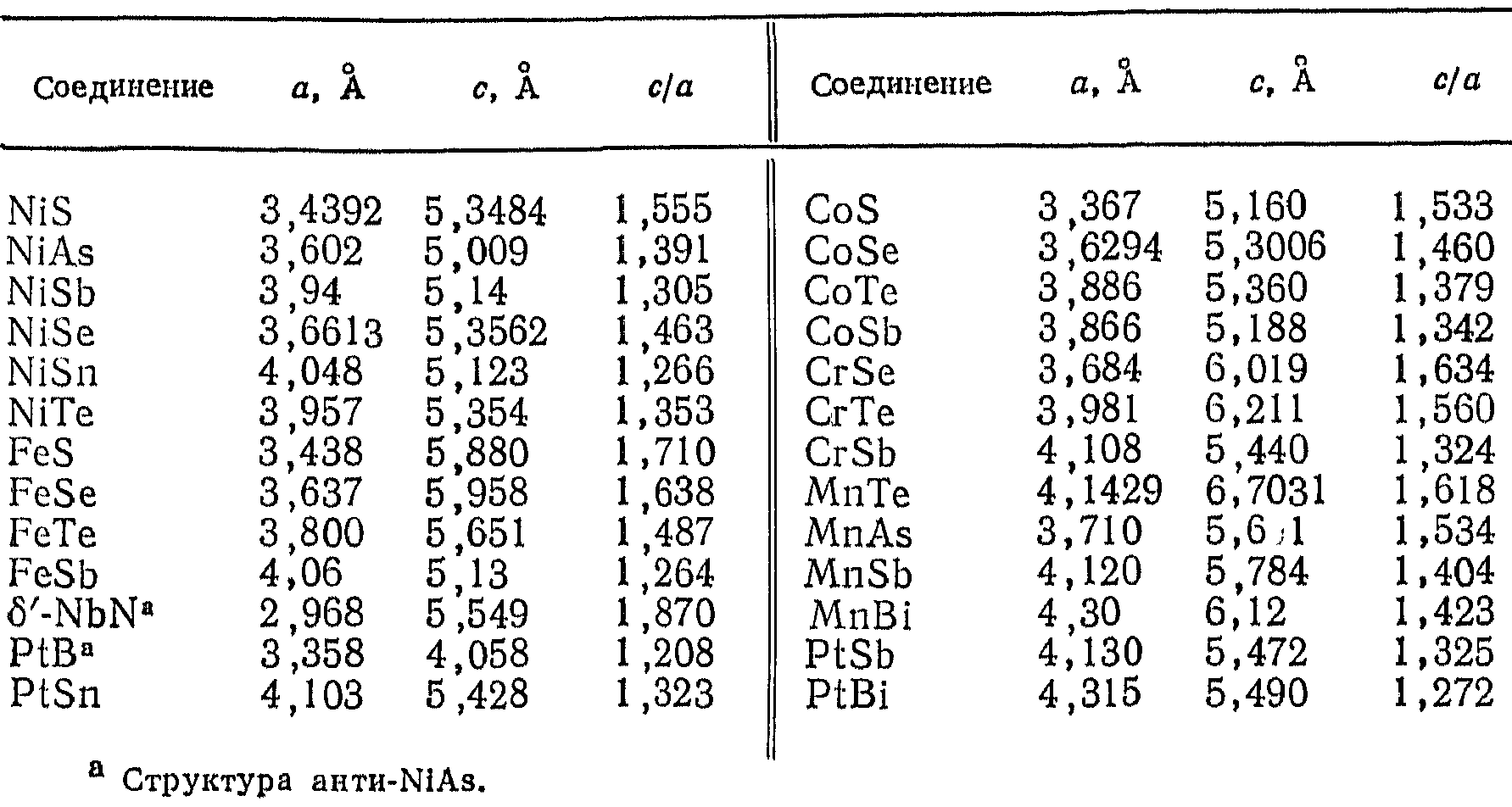
В таблице 5.8 приведены параметры гексагональных ячеек соединений, кристаллизующихся в структурах NiAs. Соединения со структурой NiAs имеют металлический характер; по такому типу кристаллизуются многочисленные интерметаллические соединения, а также халькогениды (сульфиды, селениды, теллуриды) некоторых переходных металлов. В «семействе» NiAs отношение параметров с/а значительно меняется от одного соединения к другому. Последнее находится в тесной взаимосвязи с взаимодействием металл – металл, возникающим вдоль с-иаправления.
Таблица 5.8
Соединения структурного типа NiAs
В таблице 5.9 перечислены некоторые соединения, обладающие структурой CsCl. Среди них легко выделить две группы: одна включает галогениды крупных однозарядных ионов, а другая – различные интерметаллиды.
Элементарная ячейка CsCl относится к примитивному кубическому типу. В вершинах куба расположены анионы С1-, а в центре объема куба – ион Cs+, или наоборот. Ячейка CsCl не является объемно-центрированной, поскольку в вершинах и в центре куба расположены различные ионы.
Таблица 5.9
Соединения структурного типа CsCl
Известны также соединения АВ, радикально отличающиеся по структуре от основных структурных типов.
В таблице 5.10 приведены некоторые соединения, обладающие слоистой структурой типа CdI2.
Таблица 5.10
Соединения структурного типа CdI2
6. Дефекты в кристаллах
В реальных кристаллах всегда существуют структурные нарушения, называемые несовершенствами или дефектами.
Образование дефектов в кристаллах относится к наиболее активно разрабатываемым проблемам химии твёрдого тела.
От того, насколько кристаллические структуры твёрдых тел отклоняются от идеальных, зависит ряд их важных свойств – прочность, электрическая проводимость, теплопроводность, оптические и магнитные свойства, каталитическая активность. Дефекты кристаллов иногда сообщают твердым телам весьма ценные свойства, в связи с чем их реализуют искусственным путем.
Назовём основные причины возникновения дефектов в кристаллах.
Первая обусловлена тепловым движением частиц, формирующих кристалл. С повышением температуры твердого тела энергия такого движения растет, поэтому возрастает вероятность образования дефектов, называемых собственными или тепловыми.
Другой вид дефектов связан с наличием в структуре вещества тех или иных примесей. Абсолютно химически чистых веществ не существует. Однако, влияние примесей на свойства вещества может быть незначительным, и тогда их присутствием пренебрегают. В случаях, когда присутствующие примеси существенно изменяют свойства твердого тела, говорят о дефектах химического состава кристалла или примесных дефектах.
Дефекты в кристаллах могут возникать и как следствие воздействия на них внешних механических нагрузок. Так, при необратимом растяжении кристалла наступает его пластическая деформация, при которой в материале возникают плоскости скольжения с наибольшим сдвигом. За счет механических нагрузок в кристалле могут возникать трещины и другие макродефекты.
Дефекты того или иного типа влияют на свойства твердого тела в зависимости от их положения в кристаллической решетке и числа подобных нарушений в единице объема кристалла. Обычно говорят о концентрации дефектов, относя их число или к единице объема, или к одному молю вещества.
Для классификации дефектов предложены различные подходы.
Дефекты могут быть условно разделены на стехиометрические, т.е. не связанные с изменением стехиометрии, и нестехиометрические, возникающие вследствие изменения состава кристалла.
В основу классификации могут быть положены мерность и протяженность дефектов. По размерности различают следующие виды дефектов: нульмерные (точечные), одномерные (линейные), двумерные (плоские) и трёхмерные (объемные).
К нульмерным (точечным) относят все дефекты, которые связаны со смещением или заменой небольшой группы атомов (собственные точечные дефекты), а также с примесями. Они возникают при нагреве, легировании, в процессе роста кристалла в результате радиационного облучения. Наряду с повышением температуры возникновению точечных дефектов в кристаллах способствуют большие расстояния между узлами их решеток, а также малые размеры самих частиц.
Наиболее изученные виды точечных дефектов:
вакансия – свободный, незанятый атомом, узел кристаллической решетки;
собственный межузельный атом – атом основного элемента, находящийся в междоузельном положении элементарной ячейки;
примесный атом замещения – атом одного типа, заменяющий атомом другого типа в узле кристаллической решетки. В позициях замещения могут находиться атомы, которые по своим размерам и электронным свойствам относительно слабо отличаются от атомов основы;
примесный атом внедрения – атом примеси, располагающийся в междоузлии кристаллической решетки. В металлах примесями внедрения обычно являются водород, углерод, азот и кислород. В полупроводниках – это примеси, создающие глубокие энергетические уровни в запрещенной зоне, например, медь и золото в кремнии.
Собственные точечные дефекты возникают тогда, когда отдельные, изолированные атомы, молекулы или ионы покидают свои места в узлах кристаллической решетки и переходят или в междоузлие, или на поверхность кристалла, оставляя в решетке незаполненный узел, называемый вакансией. Механизм возникновения точечных дефектов представлен на рисунке 6.1.
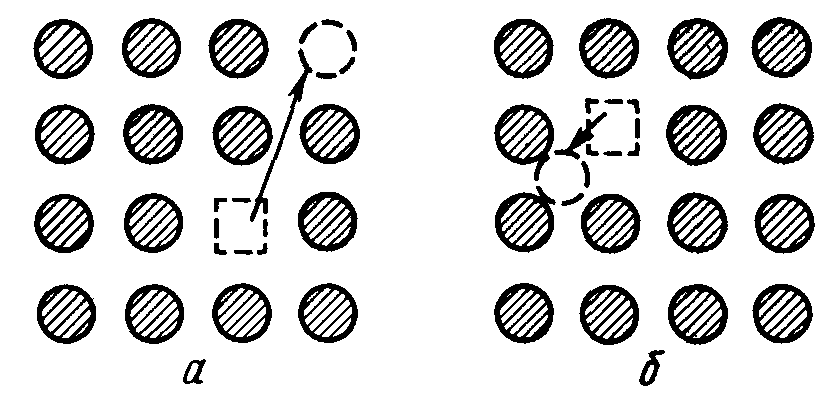
Рис. 6.1. Возникновение дефектов кристаллов: выход частиц из узла решётки на поверхность кристалла (а), выход частиц из узла решётки в междоузлие (б)
Хоть считается, что точечные дефекты состоят из одного атома или дефектной позиции – вакансии или междоузлия, однако в действительности непосредственное атомное окружение такого дефекта тоже в некоторой степени искажено.
В кристаллах часто наблюдаются также комплексы, состоящие из нескольких точечных дефектов, например, пара Френкеля (вакансия + собственный междоузельный атом), дивакансия (вакансия + вакансия).
Представления о «классических» точечных дефектах были введены в 30-х годах прошлого столетия в работах Шоттки, Френкеля, Вагнера и др.
Дефекты Шоттки относятся к стехиометрическим дефектам ионных кристаллов. Они представляют собой пару, образованную анионной и катионной вакансиями. Для сохранения электронейтральности количества анионных и катионных вакансий как в объеме, так и на поверхности кристалла должны быть равны. Дефекты Шоттки являются основным типом дефектов в галогенидах щелочных металлов. Именно дефекты Шоттки определяют оптические и электрические свойства NaCI. На рисунке 6.2 схематически изображен дефект Шоттки в NaCl.
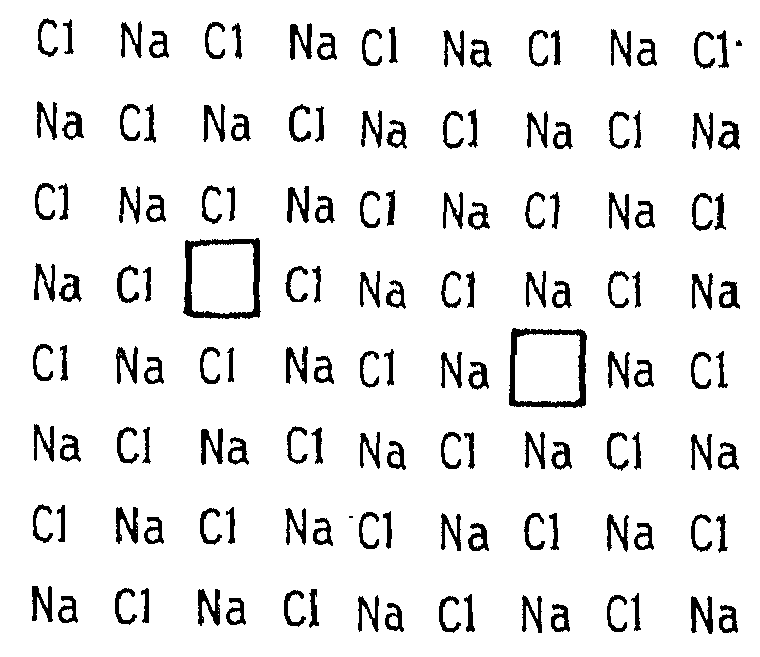
Рис. 6.2. Дефекты Шоттки, состоящие из анионной и катионной вакансий в двумерном изображении
Дефекты Френкеля также относятся к стехиометрическим. Они представляют собой атом, смещенный из его положения в решетке в межузельную позицию, которая в бездефектном состоянии не занята. Так, в хлориде серебра, который имеет структуру типа NaCl, доминируют дефекты этого типа – ионы серебра, находящиеся в междоузлиях (рис. 6.3).
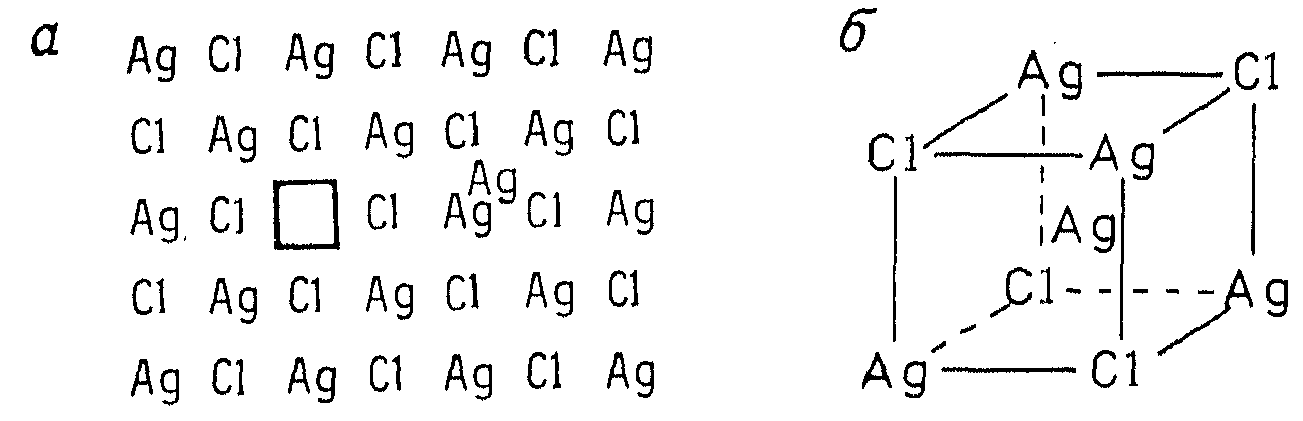
Рис. 6.3. Дефект Френкеля
Пары Френкеля и пары Шоттки, будучи суммарно электронейтральными, представляют собой диполи. Благодаря этому они могут притягиваться друг к другу, образуя большие скопления или кластеры.
Поскольку дефекты Шоттки и Френкеля относятся к собственным дефектам, то некоторое минимальное их количество непременно должно присутствовать даже в чистом кристалле по термодинамическим причинам. Однако, чаще всего число дефектов, содержащихся в кристалле, превышает их термодинамически равновесное количество.
Точечные примесные дефекты сильно влияют на свойства твердых тел. При образовании таких дефектов частицы примесей (молекулы, атомы или ионы) располагаются или в узлах пространственной решетки кристалла, вытесняя из них частицы основного вещества, или занимают места в междоузлиях. Примесные дефекты в кристаллах могут существовать или в нейтральном, или в заряженном состоянии. В определенных условиях атомы примесей могут ионизироваться, существенно изменяя свойства кристалла.
Благодаря точечным дефектам удается объяснить существование в природе большого числа так называемых «нестехиометрических» соединений (соединений переменного состава), т.е. веществ, состав которых в твердом состоянии отклоняется от их молекулярного состава. Например, кристаллы оксида титана (в зависимости от давления кислорода в окружающей среде) могут иметь переменный состав от ТiO0.6 до ТiO1.35. При избытке атомов титана в кристалле имеется соответствующая концентрация вакансий кислорода, а при избытке атомов кислорода появляются вакансии титана. В кристаллах оксида цинка ZnO избыточное содержание атомов цинка объясняют нахождением последних в междоузлиях пространственной решетки.
Дефекты нестехиометрических кристаллов могут быть приготовлены путем легирования чистого кристалла гетеровалентными примесями, т.е. примесями, включающими атомы в степенях окисления, отличающихся от атомов матрицы.
Более сложным видом нарушений структуры кристалла являются линейные дефекты. Их возникновение обусловлено нарушением местоположения целой группы частиц, размещенных вдоль какой-либо воображаемой линии в кристалле.
Линейные дефекты представляют собой дефекты кристалла, размер которых по одному направлению намного больше параметра решетки, а по двум другим – соизмерим с ним. К линейным дефектам относят дислокации и дисклинации.
Дислокация – это граница области незавершенного сдвига в кристалле. Дислокации характеризуются вектором сдвига (вектором Бюргерса) и углом φ между ним и линией дислокации. При φ=0 дислокация называется винтовой, при φ=90° – краевой, при других углах – смешанной и тогда может быть разложена на винтовую и краевую компоненты.
Дисклинация – это граница области незавершенного поворота в кристалле. Дисклинация характеризуется вектором поворота.
Дислокации возникают в процессе роста кристалла, при его пластической деформации и во многих других случаях. Их распределение и поведение при внешних воздействиях определяют важнейшие механические свойства, в частности, прочность, пластичность и др.
Возникновение дислокаций требует большой энергии, поэтому их число мало зависит от температуры кристалла и в обычных кристаллических образцах имеет порядок 106-107 в 1см3. Как правило, дислокации образуются в процессе выращивания кристалла или при его механической и термической обработке.
Иногда считают, что точечные дефекты и дислокации должны изучаться разными направлениями науки о твёрдом теле. При этом вакансии, межузельные атомы, а также дефекты упаковки считают «химическими» дефектами, свойственными данной структуре. Им отводят важную роль в химических реакциях и массопереносе. Дислокации же рассматривают скорее как «физические дефекты» и считают их ответственными, в основном, за механические свойства материалов. Однако, на современном уровне понимания поведения дефектов стало вполне ясно, что в реальных процессах дислокации и точечные дефекты тесно связаны.
Еще более сложным видом искажений кристалла служат двумерные, т.е. плоские дефекты. Их наличие приводит к тому, что поликристаллические вещества состоят из определенного набора зерен или блоков, соединенных между собой и ориентированных произвольным образом (рис. 6.4,в). Области на границах между зернами имеют искаженную кристаллическую структуру.
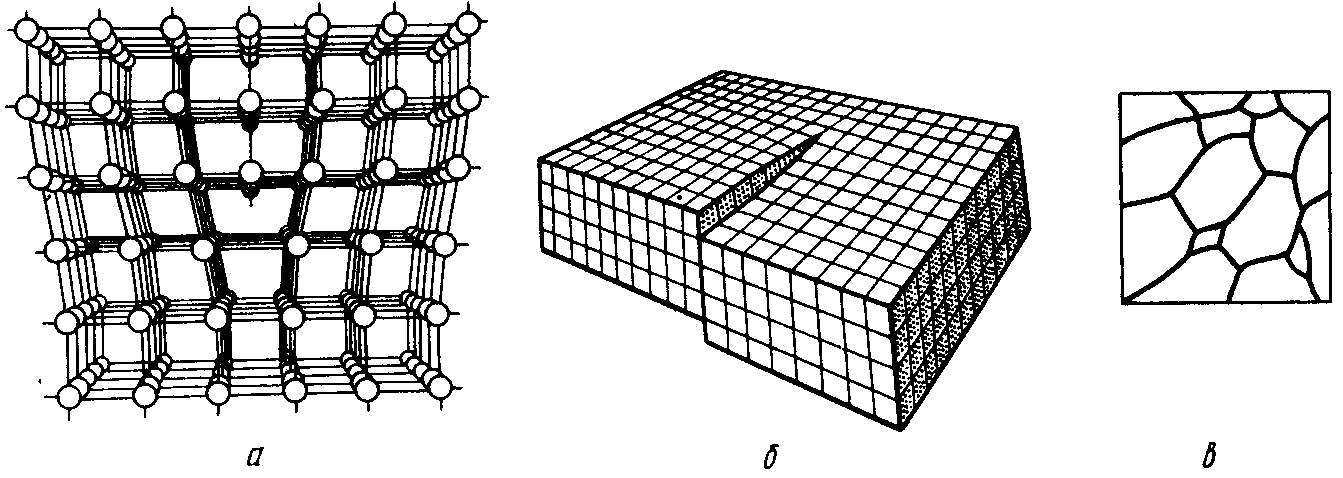
Рис. 6.4. Краевые (а) и винтовые (б) дислокации и плоские дефекты (в) кристаллов
Особенности блочной структуры вещества существенно влияют на оптические и электрические характеристики твердого тела, а также на его химическую активность. Вещество на границах зерен и блоков обладает, как правило, повышенной реакционной способностью и может даже отличаться от остального объема зерна по химическому составу.
Двумерные дефекты типичны для материалов со слоистой структурой и в особенности для тех из них, которым характерна политипия. Среди металлов такой материал – кобальт, который может находиться в двух основных формах (политипах), различающихся по способу упаковки атомов металла. Это может быть плотнейшая кубическая упаковка, чему отвечает последовательность слоев ...АВСАВС..., или плотнейшая гексагональная с последовательностью ...АВАВАВ....
Графиту, для которого также характерно явление политипии (обычно он образует гексагональную плотнейшую и реже плотнейшую кубическую упаковки), весьма характерны дефекты упаковки, возникающие при смешении этих двух политипов.
Наличие дислокаций и плоских дефектов в реальных кристаллах сильно сказывается на механических свойствах твердых тел. Однако это не означает, что монокристаллы вещества по прочности всегда превосходят его поликристаллические конгломераты. Всё зависит от степени взаимодействия дислокаций и плоских дефектов с другими дефектами твердого тела. Так, монокристаллы чистого железа очень пластичны, в то время как монокристаллы стали, имеющие блочную структуру, наряду с твёрдорастворным (C в Fe) упрочнением проявляют большую прочность, также за счет взаимодействия дислокаций с примесными дефектами. Междоузельные примесные дефекты, как правило, затрудняют движение дислокаций, осложняя механическую обработку металлов. В связи с этим при механической обработке высокопрочных металлов, таких, как титан, молибден, бериллий, вольфрам, обычно проводят их тщательную очистку от примесей азота и кислорода.
