
- •Предмет химии твёрдого тела
- •2. Классификация кристаллических тел по симметрии кристаллов
- •Классификация решёток
- •3. Типы химических связей в кристаллах
- •Некоторые характеристики веществ при 298,16 к
- •4. Классификация твёрдых тел по особенностям зонной структуры
- •5. Элементы кристаллохимии твёрдых тел
- •Кубическая (гранецентрированная) (б)
- •Структуры и параметры элементарных ячеек некоторых металлов
- •Некоторые структуры с плотной упаковкой
- •Описание некоторых структурных типов
- •Типы соединений со стехиометрией ав
- •Некоторые соединения со структурой типа NaCl
- •Некоторые соединения со структурой сфалерита
- •Соединения со структурой вюртцита
- •Расчёт межатомных расстояний в некоторых простых структурах
- •Соединения структурного типа NiAs
- •Соединения структурного типа CsCl
- •Соединения структурного типа CdI2
- •6. Дефекты в кристаллах
- •7. Диффузия в твёрдых телах
- •Граница раздела
- •Через границу раздела Cu/CuZn
- •8. Гетерогенные и топохические реакции
- •8.1. Реакции окисления металлов и сплавов
- •8.2. Реакции восстановления железа из его оксидов
- •8.3. Реакции образования шпинелей
- •9. Аморфные твёрдые тела – стекла
- •Национальная металлургическая академия Украины
- •Редакционно-издательский отдел нМетАу
Некоторые структуры с плотной упаковкой
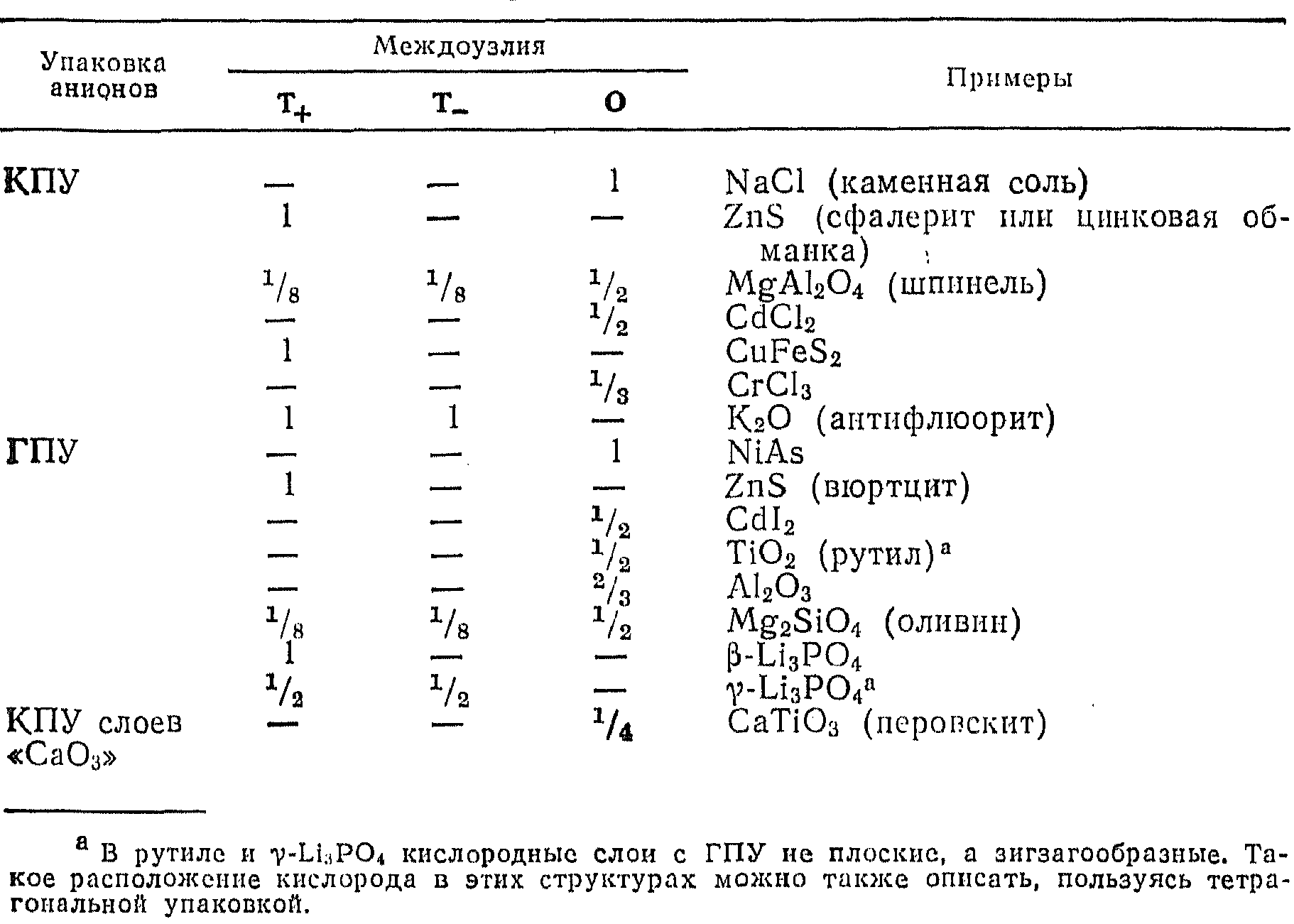
Некоторые (впрочем, немногочисленные) структуры можно представить как образованные слоями с плотной упаковкой катионов, между которыми находятся анионы. Наиболее типичный пример таких структур-флюорит CaF2.
Структура антифлюорита, в которой кристаллизуется, например, К2О, в этом смысле является обратной структуре флюорита (табл. 5.2).
Концепция плотной упаковки распространяется и на такие структуры, в которых плотноупакованные слои содержат в своем составе крупные катионы и анионы, а междоузлия заполнены катионами меньшего размера.
В рамках представлений о плотной упаковке или эвтактических структурах можно описать также структуры веществ с ковалентными связями, характеризующимися большой прочностью и направленностью; при таком подходе выясняется, что многие ковалентные структуры тождественны структурам ионных соединений.
Так, алмаз можно представить себе в виде структуры, в которой половина атомов углерода образует решетку с КПУ, а вторая половина занимает в этой решетке тетраэдрические междоузлия Т+; в этом случае оба типа атомов эквивалентны.
Плотная упаковка реализуется при образовании структур не только из атомов или ионов: многие молекулярные соединения кристаллизуются, образуя структуры с плотной упаковкой, несмотря на то, что между соседними молекулами в них действуют лишь слабые Ван-дер-Ваальсовы силы.
Гексагональная и кубическая плотные упаковки относятся к наиболее «экономным» способам укладки шаров в пространстве (для этих структур характерны координационное число 12 и высокая степень заполнения объема, равная 74,05%). Примитивная тетрагональная упаковка (ПТУ) и объемно-центрированная тетрагональная упаковка (ОЦТУ) приводят к несколько меньшим координационным числам (11 и 10) и меньшему заполнению объема (71,87 и 69,81%).
Описание некоторых структурных типов
Большое количество структур объединяют в одно семейство, что позволяет выявить их общие черты и различия.
Так, существует пять основных структурных типов со стехиометрией АВ: NaCl, CsCl, NiAs, сфалерит и вюртцит; каждый из этих структурных типов объединяет множество соединений.
Таблица 5.3
Типы соединений со стехиометрией ав
ТИП
|
ОПИСАНИЕ |
КЧ (А) |
КЧ (В) |
СОЕДИНЕНИЯ |
NaCl |
ГЦК упаковка В, А заполняют все октаэдрические пустоты |
6 |
6 |
NaCl, KBr, LiF, ZrO, MgO, BaS, PbS, UC |
CsCl |
Простая кубическая упаковка В, А заполняют все пустоты |
8 |
8 |
CsCl, CsBr, CsI, RbCl, AlCo, AgZn, BeCu, RuAl |
Сфалерит |
ГЦК упаковка В, А заполняют 1/2 тетраэдрических пустот |
4 |
4 |
ZnS(сфалерит), AgI, AlP, BaS, CdS, CuF, GaAs, SiC |
Вюртцит |
ГП упаковка В, А заполняют 1/2 тетраэдрические пустоты |
4 |
4 |
ZnS(вюртцит), ZnO, SiC, AlN, CdSe |
NiAs |
ГП упаковка В, А заполняют октаэдрические пустоты |
6 |
6 |
NiAs, CoTe, CrSe, FeS, NiSn, PtB, VP, ZrTe |
Большое число соединений со стехиометрией АВ кристаллизуется в структуре каменной соли. Параметры кубических элементарных ячеек этих соединений приведены в таблице 5.4. К этому структурному типу относятся многие галогениды и гидриды щелочных металлов, серебра и аммония, многочисленные халькогениды (включая оксиды) двухвалентных металлов, в том числе щелочноземельных и переходных. Многие из этих соединений являются ионными, а другие, например TiO, имеют металлический характер.
В таблице 5.5 приведены параметры элементарных ячеек соединений со стехиометрией АВ, кристаллизующихся в структуре сфалерита. Связь в этих соединениях менее ионная, чем в соответствующих соединениях АВ со структурой каменной соли, поэтому оксиды обычно не образуют структуры сфалерита.
Сульфиды, селеииды и теллуриды щелочноземельных металлов имеют структуру каменной соли, тогда как более ковалентные халькогениды Be, Zn, Cd и Hg относятся к структурному типу сфалерита.
Таблица 5.4
