
- •Предмет химии твёрдого тела
- •2. Классификация кристаллических тел по симметрии кристаллов
- •Классификация решёток
- •3. Типы химических связей в кристаллах
- •Некоторые характеристики веществ при 298,16 к
- •4. Классификация твёрдых тел по особенностям зонной структуры
- •5. Элементы кристаллохимии твёрдых тел
- •Кубическая (гранецентрированная) (б)
- •Структуры и параметры элементарных ячеек некоторых металлов
- •Некоторые структуры с плотной упаковкой
- •Описание некоторых структурных типов
- •Типы соединений со стехиометрией ав
- •Некоторые соединения со структурой типа NaCl
- •Некоторые соединения со структурой сфалерита
- •Соединения со структурой вюртцита
- •Расчёт межатомных расстояний в некоторых простых структурах
- •Соединения структурного типа NiAs
- •Соединения структурного типа CsCl
- •Соединения структурного типа CdI2
- •6. Дефекты в кристаллах
- •7. Диффузия в твёрдых телах
- •Граница раздела
- •Через границу раздела Cu/CuZn
- •8. Гетерогенные и топохические реакции
- •8.1. Реакции окисления металлов и сплавов
- •8.2. Реакции восстановления железа из его оксидов
- •8.3. Реакции образования шпинелей
- •9. Аморфные твёрдые тела – стекла
- •Национальная металлургическая академия Украины
- •Редакционно-издательский отдел нМетАу
5. Элементы кристаллохимии твёрдых тел
Пространственное расположение, химическую связь микрочастиц в кристаллах, а также зависимость свойств кристаллических тел от их строения изучает наука кристаллохимия.
Кристаллы многих веществ имеют сходную пространственную структуру. Если при этом их химическая природа также подобна, то такие вещества называют изоморфными. Если это вещества различной химической природы, их называют изоструктурными.
Структуру кристаллов можно описать несколькими способами. Наиболее традиционный путь, дающий информацию о структуре, опирается на понятие элементарной ячейки. При таком подходе структура определяется типом и размерами элементарной ячейки, а также расположением атомов внутри неё.
Однако, иногда информации об элементарной ячейке и координатах атомов бывает недостаточно для ясного представления пространственной структуры твёрдого тела. В таких случаях выделяют большую по объему область кристалла. Например, включают в рассмотрение несколько элементарных ячеек; при этом анализируют расположение атомов друг относительно друга, их координационные числа КЧ (т.е. количество частиц, непосредственно примыкающих к данной), межатомные расстояния, типы связи и т.д. Такой подход позволяет сравнивать разные структурные типы кристаллических тел.
В структурные типы объединяют кристаллические тела, обладающие одинаковой пространственной структурой и одинаковым размещением атомов по кристаллохимическим позициям (орбитам). Наиболее известные структурные типы:
простых веществ – меди, магния, α-железа, алмаза;
бинарных соединений – хлорида натрия (NaCl), сфалерита (ZnS), вюртцита (ZnS), хлорида цезия (CsCl), флюорита (CaF2);
тройных соединений – перовскита (CaTiO3), шпинели (MgAl2O4 и др.).
Размещение частиц в пространственной решетке осуществляется таким образом, чтобы обеспечить максимально возможную для данного типа кристалла энергию их связи, а также энергетическую однородность в целом. Для частиц сферической формы наиболее благоприятным часто оказывается такое их размещение, при котором каждая сфера находится в соприкосновении с наибольшим числом ближайших соседей. Подобные пространственные образования называются структурами плотнейшей упаковки.
Принцип описания строения веществ в приближении плотнейших упаковок относят к числу наиболее плодотворных.
В кристаллах, образованных сферическими частицами одинакового размера, их плотнейшая упаковка может осуществляться в виде двух энергетически равноценных структур: кубической (гранецентрированной) и гексагональной (рис. 5.1). Координационное число для каждой из этих структур равно 12, а сами сферы занимают ~74% полного объема кристалла. В подобных структурах кристаллизуются большинство металлов и сплавов. Структура многих ионных, ковалентных и молекулярных кристаллов также могут быть описаны, исходя из представлений о плотнейшей упаковке.
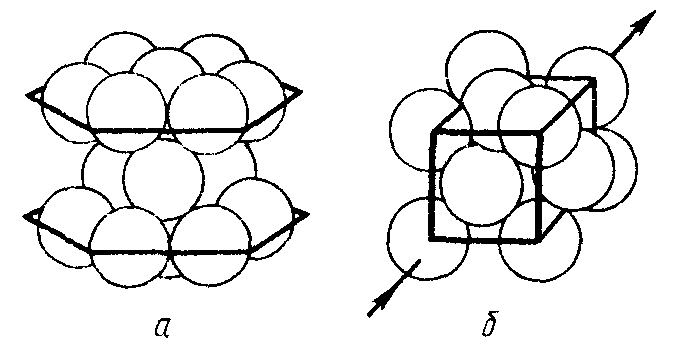
Рис. 5.1. Плотнейшие упаковки шаров: гексагональная (а) и
Кубическая (гранецентрированная) (б)
Если частицы, образующие кристалл, не являются сферическими или имеют разные размеры, то их плотнейшая упаковка будет искажаться. При этом значение координационного числа будет меньше 12, а доля незанятого объема в кристалле будет расти.
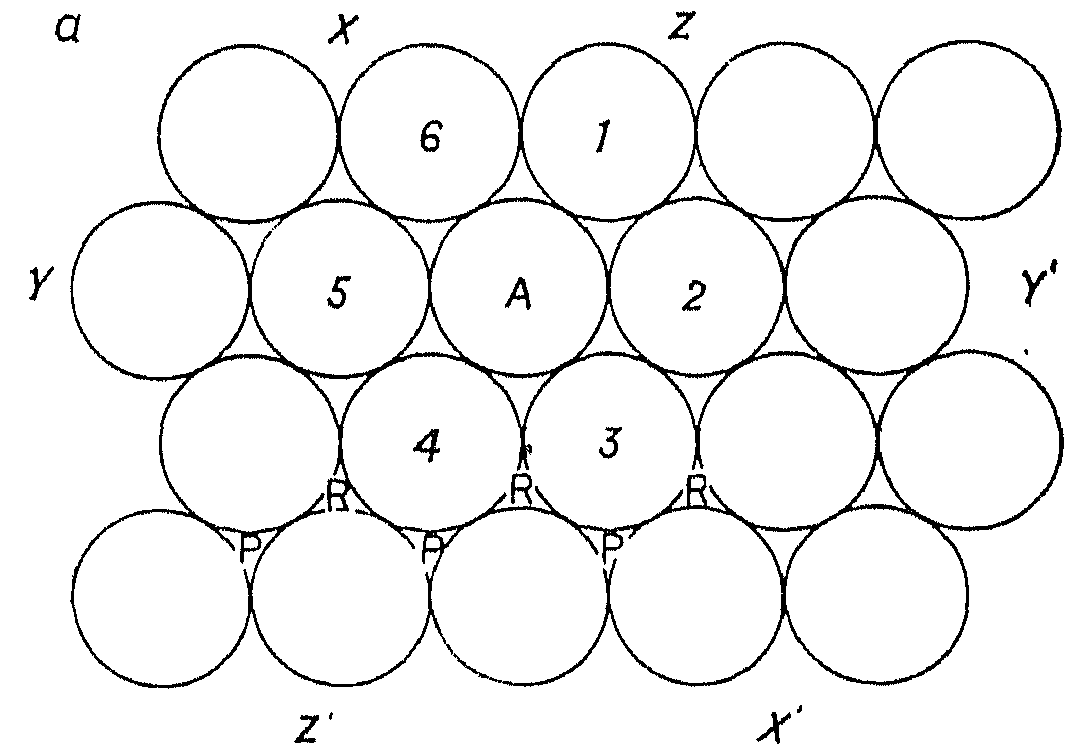
Рис. 5.2. Плотноупакованный слой шаров одинакового размера
Плотная упаковка шаров одинакового размера в двух измерениях показана на рисунке 5.2: каждый шар, например А, касается шести других окружающих его шаров. Путем регулярного повторения этого мотива образуются бесконечные плотноупакованные слои.
В плотноупакованном слое выделяются три направления плотной упаковки (направления XX', YY' и ZZ′ на рис. 5.2), вдоль которых расположены ряды соприкасающихся шаров; так, шар А принадлежит одновременно всем трех рядам.
Наиболее эффективный способ трехмерной упаковки шаров заключается в последовательной укладке друг на друга плотноупакованных слоев шаров. Назовём их А, В, С и т.д. Возможны два простых способа упаковки слоев – АВАВАВ и АВСАВСАВС, соответствующие структурам с гексагональной плотнейшей упаковкой (ГПУ) и кубической плотнейшей упаковкой (КПУ). ГПУ и КПУ относятся к простейшим и в то же время наиболее важным для структурной химии типам последовательностей при упаковке слоев.
В структурах с плотной упаковкой каждый шар касается 12 других шаров; это максимально возможное координационное число, которое достигается лишь для сфер одинакового диаметра.
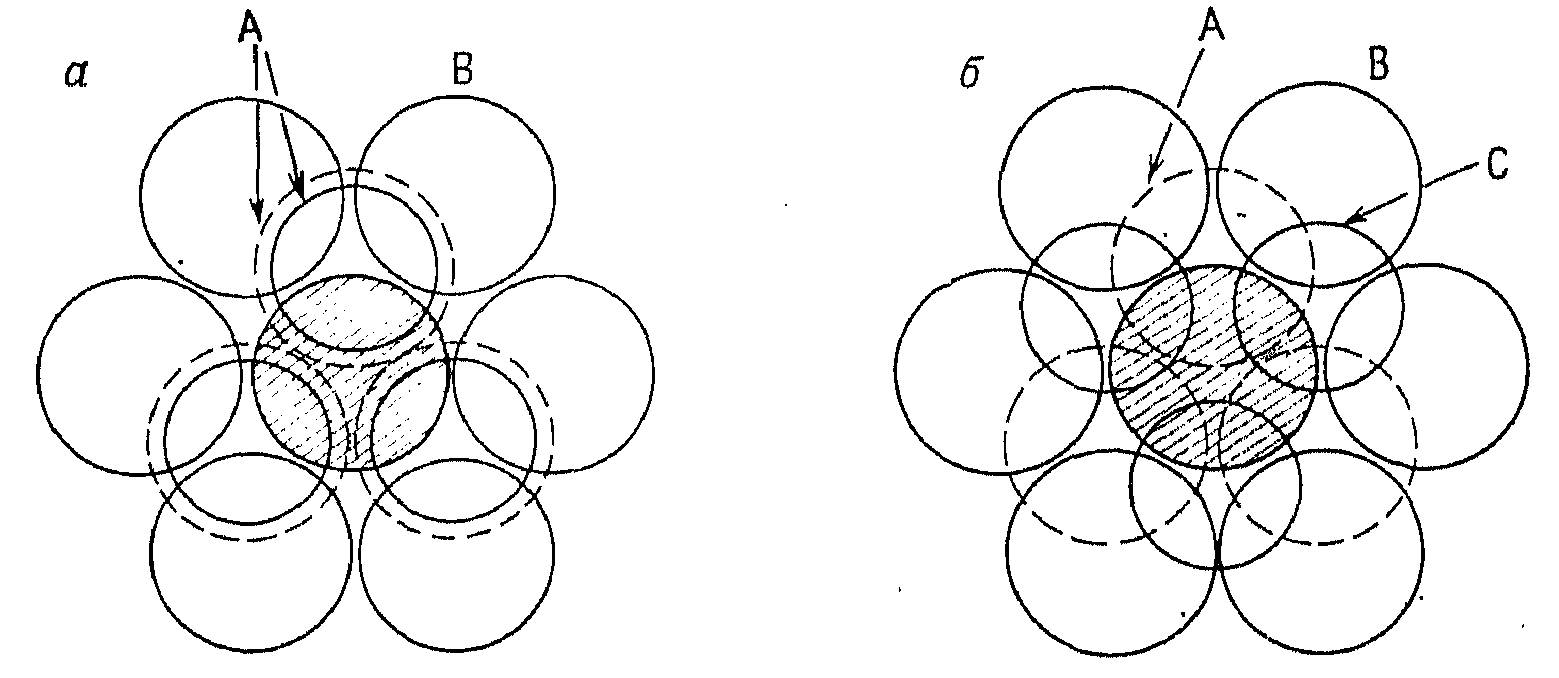
Рис. 5.3. Координационное окружение центрального (заштрихованного) шара с КЧ 12 в структурах с ГПУ (а) и КПУ (б)
Шесть ближайших соседей лежат в одной плоскости с центральным шаром (рис. 5.3), а остальные шесть, как видно из рисунков 5.2 и 5.3, расположены в слоях выше и ниже данного слоя, по три шара в каждом слое. В этом отношении ГПУ и КПУ различаются лишь относительной ориентацией этих троек шаров ближайшего окружения.
В структурах с плотнейшей шаровой упаковкой занято 74,05% общего объема. Эта степень заполнения – предельно возможная для структур, построенных из шаров одинакового диаметра.
В структурах, не имеющих плотной упаковки, коэффициент заполнения объема меньше, чем 0,7405. Так, например, для объёмноцентрированной кубической структуры (ОЦК) коэффициент заполнения равен 0,6802.
Большинство металлов кристаллизуется в одном из трех типов структуры – КПУ, ГПУ и ОЦК, из которых два первых обладают плотнейшей упаковкой. В распределении металлов по этим структурным типам (табл. 5.1) трудно проследить какую-нибудь явную закономерность, причем в вопросе о том, почему какой-либо металл кристаллизуется в этом, а не другом структурном типе, до сих пор нет настоящей ясности. Расчеты показывают, что энергии решеток металлов с ГПУ- и КПУ-структурами сравнимы по величине и, следовательно, наблюдаемые структурные различия вызваны тонкими различиями их зонного строения.
Таблица 5.1
