
- •Предмет химии твёрдого тела
- •2. Классификация кристаллических тел по симметрии кристаллов
- •Классификация решёток
- •3. Типы химических связей в кристаллах
- •Некоторые характеристики веществ при 298,16 к
- •4. Классификация твёрдых тел по особенностям зонной структуры
- •5. Элементы кристаллохимии твёрдых тел
- •Кубическая (гранецентрированная) (б)
- •Структуры и параметры элементарных ячеек некоторых металлов
- •Некоторые структуры с плотной упаковкой
- •Описание некоторых структурных типов
- •Типы соединений со стехиометрией ав
- •Некоторые соединения со структурой типа NaCl
- •Некоторые соединения со структурой сфалерита
- •Соединения со структурой вюртцита
- •Расчёт межатомных расстояний в некоторых простых структурах
- •Соединения структурного типа NiAs
- •Соединения структурного типа CsCl
- •Соединения структурного типа CdI2
- •6. Дефекты в кристаллах
- •7. Диффузия в твёрдых телах
- •Граница раздела
- •Через границу раздела Cu/CuZn
- •8. Гетерогенные и топохические реакции
- •8.1. Реакции окисления металлов и сплавов
- •8.2. Реакции восстановления железа из его оксидов
- •8.3. Реакции образования шпинелей
- •9. Аморфные твёрдые тела – стекла
- •Национальная металлургическая академия Украины
- •Редакционно-издательский отдел нМетАу
Некоторые характеристики веществ при 298,16 к
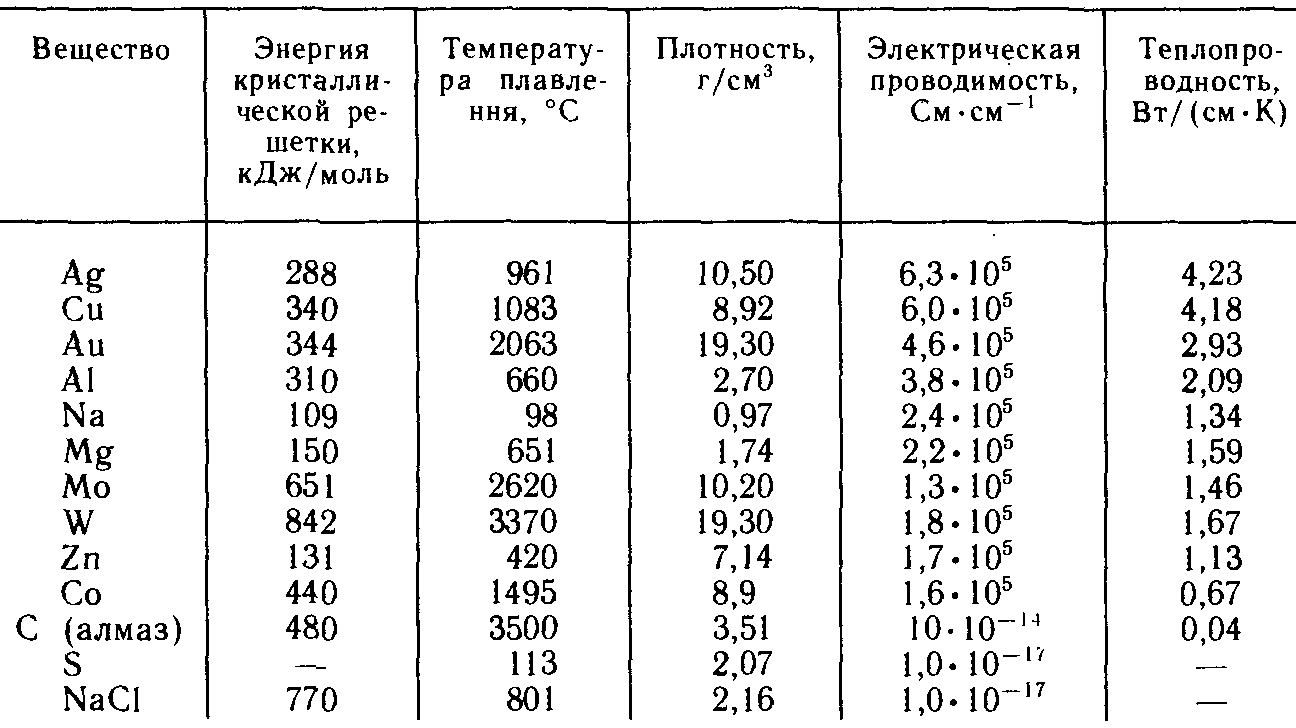
Плотность большинства металлов значительна, что свидетельствует об очень плотной структуре металлических кристаллов. Однако, такие свойства металлов, как высокие ковкость и тягучесть, указывают на отсутствие жесткости в металлических решетках: их плоскости довольно легко сдвигаются одна относительно другой.
Чрезвычайно высокие, по сравнению с другими типами кристаллов, значения электрической проводимости и теплопроводности металлов указывают на высокую подвижность и большую «свободу» электронов в их пространственной структуре. С точки зрения строения атомов, типичные металлические свойства проявляют элементы, обладающие небольшим числом валентных электронов, и, напротив, большим количеством незаполненных орбиталей на внешнем квантовом слое. За счет перечисленных особенностей при кристаллизации атомы вещества упаковываются с максимально возможной плотностью так, чтобы их незаполненные орбитали оказались как можно более полно заселены небольшим числом имеющихся валентных электронов соседних атомов.
Говоря о типе связи в кристалле, необходимо иметь в виду, что связь между двумя атомами никогда полностью не соответствует одному из описанных типов. В ионной связи всегда присутствует элемент ковалентной связи и т.п. А в сложных веществах связь между разными атомами может быть разного типа.
Так, в молекулярных кристаллах типа H2O, HCl наряду с силами Ван-дер-Ваальса действуют водородные силы.
Ярким примером кристаллов со смешанными связями служит одна из форм углерода – графит, структура которого приведена на рисунке 3.3. Атомы углерода связаны друг с другом ковалентными связями так, что они образуют плоские двумерные слои. Связь между двумерными слоями графита осуществляется только за счёт слабых сил Ван-дер-Ваальса. Таким образом, графит является молекулярным кристаллом в одном направлении и ковалентным – в другом направлении.
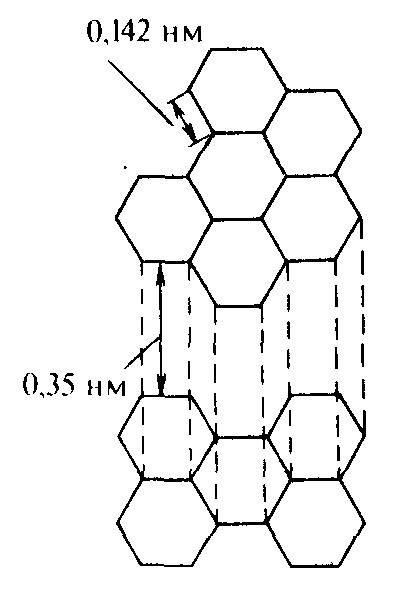
Рис. 3.3. Кристаллическая структура графита
Расстояние между слоями графита достаточно велико, поэтому между ними могут внедряться другие атомы или молекулы. При этом образуются соединения, называемые соединениями внедрения, слоистыми соединениями или клатратами. Примерами таких соединений являются фториды графита CFх, в которых атомы фтора внедрены между слоями решетки графита.
4. Классификация твёрдых тел по особенностям зонной структуры
Теория твердого тела должна удовлетворительно объяснять наблюдающиеся различия в электрической проводимости твёрдых тел.
Одно из наиболее характерных свойств металлов – высокая электрическая проводимость, обусловленная направленным переносом их электронов в электрическом поле. Ряд твердых веществ с молекулярной, ионной или ковалентной решеткой образуют класс диэлектриков. Их электрическая проводимость на 20-30 порядков ниже электрической проводимости металлов. Большое число веществ занимает промежуточное положение между металлами и диэлектриками и относятся к классу полупроводников. При очень низких температурах полупроводники не проводят электрический ток, т.е. являются типичными диэлектриками. По мере роста температуры их электрическая проводимость возрастает.
Ни теория ковалентной связи, рассматривающая электроны, принадлежащие лишь данной химической связи как в ковалентных кристаллах, ни модель свободного электрона в металлах не в состоянии объяснить изменение электрической проводимости твердых тел больше, чем на два порядка. Успешным является применение в теории твердого тела квантово-механических представлений.
Теория, объясняющая свойства твердых тел на основании анализа строения и плотности заполнения электронами энергетических зон в кристаллах, называется зонной теорией. Зонная теория позволила классифицировать все твердые тела по качественным особенностям их зонной структуры.
Понятия зонной структуры и зоной теории твердого тела были введены Ф.Блохом и Р.Пайерлсом в конце 1930-х годов. Термины «зонная структура» и «зонная теория» отражают своеобразный характер энергетического спектра электронов в твёрдом теле.
В зонной теории твердое тело рассматривается как совокупность ионов и электронов проводимости.
В основе зонной теории лежат три главных приближения:
Твердое тело представляет собой идеально периодический кристалл.
Вследствие малости отношения масс электрона и иона равновесные положения узлов кристаллической решетки фиксированы, т.е. ядра считаются неподвижными.
Воздействие на данный электрон всех остальных электронов описывается некоторым эффективным усредненным внешним полем, в котором каждый электрон движется независимо.
Образование кристаллического твердого тела можно представить как результат сближения свободных атомов до столь малых расстояний, что волновые функции электронов в атомах начинают перекрываться, и электроны получают возможность перемещаться от атома к атому. В процессе сближения атомов увеличивается их взаимодействие, в результате чего энергетический спектр электрона в атоме превращается в энергетический спектр электрона в твердом теле.
При образовании кристалла происходит перекрывание внешних электронных орбиталей атомов по аналогии с образованием химической связи в молекулах.
Число электронных орбиталей в твердом теле чрезвычайно велико, а разность между энергиями соседних орбиталей мала. (Например, в кристалле натрия разность энергетических уровней двух соседних орбиталей имеет порядок 10-28Дж). При большом числе энергетических уровней разность между ними настолько мала, что они образуют почти непрерывную зону энергий.
Уровни энергии атомных электронов в кристаллах, расщепляясь, образуют энергетические зоны. Между энергетическими зонами, образованными взаимодействиями атомных орбиталей, могут возникать области запрещенных энергий, называемые запрещенными зонами. Таким образом, энергетический спектр электронов в твёрдом теле представляет собой ряд зон, разделенных запрещенными областями энергий.
Приложенное к кристаллу электрическое поле несколько изменяет относительные энергии орбиталей в зонах, понижая одни уровни и повышая другие (по отношению к силовым линиям поля). Это, в свою очередь, приводит к направленному переносу электронов на энергетически более выгодные орбитали, т.е. вызывает электронную проводимость кристалла. Так, в кристаллах металла образуется энергетическая зона с почти непрерывным распределением энергии, называемая зоной проводимости.
При температуре абсолютного нуля электроны кристалла занимают нижайшие одноэлектронные энергетические уровни. Энергия, ниже которой все электронные состояния заполнены при абсолютном нуле, а выше которой все состояния пусты, называется энергией Ферми. Изоэнергетическая поверхность, соответствующая энергии Ферми, называется поверхностью Ферми.
Если энергия Ферми EF лежит внутри полосы разрешенных энергий, то вблизи ЕF будут располагаться свободные состояния. Под влиянием электрического поля, приложенного к кристаллу, электроны будут перемещаться по свободным состояниям. Твердые тела с такой структурой энергетического спектра – металлы.
Твердые тела, в которых разрешенные зоны не перекрываются, причем часть из них полностью заполнена (валентные зоны), а остальные пусты (зоны проводимости), называются диэлектриками. В диэлектриках запрещённая зона имеет ширину до 10 эВ.
Так, в диэлектрике-алмазе запрещенная зона имеет ширину порядка 6 – 7 эВ. Из условий минимума энергии все валентные электроны атомов углерода заполняют нижнюю зону. Эта зона (ее называют валентной) оказывается заполненной полностью. Зона же проводимости кристалла пуста. Для перехода в эту зону электронам необходимо сообщить энергию порядка 7 эВ (680 кДж/моль). Требуемая энергия превышает энергию связи в кристалле алмаза и не может быть реализована. Поэтому подобные вещества не проводят электрический ток и являются диэлектриками. Алмаз и при комнатной температуре остается хорошим изолятором, так как тепловой энергии недостаточно для переброски электронов из валентной зоны в зону проводимости.
Твёрдые тела, в которых разрешённые зоны энергии (зона проводимости и валентная зона) также не перекрываются, но расстояние между ними составляет менее 3,5 эВ, являются полупроводниками. Таким образом, полупроводники отличаются от диэлектриков меньшей шириной запрещенной зоны: CdS – 2,5; Ge – 0,74; Si – 1,15; SiC – 2,43-3,29 в зависимости от политипа; GaAs – 1,5 эВ. Все эти кристаллы в чистом виде при абсолютном нуле являются изоляторами.
Если ширина запрещенной зоны относительно невелика, то при сообщении твердому телу определенного количества энергии часть его электронов может переброситься из полностью заполненной валентной зоны в зону проводимости и принять участие в переносе тока. Подобные вещества называют собственными полупроводниками. У типичных собственных полупроводников германия и кремния ширина запрещенной зоны при 0К соответственно составляет 0,75 и 0,21 эВ (73 и 137 кДж/моль). В германии и кремнии уже при комнатной температуре заметное число электронов переходит из валентной зоны в зону проводимости.
Особенность собственных полупроводников состоит в том, что при переходе части электронов в зону проводимости в валентной зоне появляется эквивалентное им число так называемых дырок, имеющих положительный заряд, которые также могут участвовать в переносе тока. Если в валентной зоне появляется малое число свободных мест, говорят не о движении многих электронов, а о движении дырок. Таким образом, собственные полупроводники имеют электронно-дырочную проводимость. Собственные полупроводники слабо пропускают ток.
Наряду с собственными полупроводниками большое распространение получили также полупроводники примесного типа. В них основное число переносчиков тока – электронов или дырок – поставляют введенные в собственный полупроводник специальные примеси, энергетические уровни которых располагаются между валентными зонами и зонами проводимости полупроводника. Уровни энергий примесей – доноров расположены в запрещенной зоне под зоной проводимости и поставляют в нее электроны. Соответствующие кристаллы называются электронными, или п-типа полупроводниками. Уровни энергий примесей – акцепторов расположены в запрещенной зоне над валентной зоной и захватывают из нее электроны, обусловливая дырочную проводимость. Полупроводники с такими примесями называются дырочными, или р-типа полупроводниками. Так, при введении в кристалл германия донорных примесей – фосфора, мышьяка, сурьмы – электроны последних переходят в зону проводимости полупроводника, резко увеличивая в ней число электронов-переносчиков тока (n-проводимость). При добавлении к германию акцепторных примесей – бора, алюминия, индия – электроны валентной зоны полупроводника переходят на свободные уровни зоны примесей, что увеличивает число дырок в валентной зоне (р-проводимость).
Итак: согласно представлениям квантовой механики, в твёрдом теле энергетический спектр электронов состоит из отдельных разрешённых энергетических зон, разделённых зонами запрещённых энергий. В соответствии с взаимным расположением энергетических зон твёрдые тела делят на три большие группы:
проводники – зона проводимости и валентная зона перекрываются, образуя одну зону, называемую зоной проводимости; электрон может свободно перемещаться между ними, получив любую допустимо малую энергию; к проводникам относят все металлы;
диэлектрики – зоны не перекрываются и расстояние между ними составляет более 3,5 эВ. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется значительная энергия, поэтому диэлектрики ток практически не проводят;
полупроводники – зоны не перекрываются и расстояние между ними составляет менее 3,5 эВ. Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется энергия меньшая, чем для диэлектрика.
Полупроводниковые химические соединения делят на простые и сложные.
Простые твёрдые полупроводниковые материалы – это собственно химические элементы. Бор B, германий Ge, кремний Si, селен Se и йод I нашли самостоятельное применение. Углерод C, сера S, сурьма Sb, теллур Te чаще всего применяются в качестве легирующих добавок или в качестве компонентов сложных полупроводниковых материалов.
Сложные полупроводниковые материалы – это химические соединения, обладающие полупроводниковыми свойствами и включающие в себя два, три и более химических элементов. Полупроводниковые материалы, состоящие из двух элементов, называют бинарными. Они имеют наименование того компонента, металлические свойства которого выражены слабее. Так, бинарные соединения, содержащие мышьяк, называют арсенидами, серу – сульфидами, теллур – теллуридами, углерод – карбидами.
Сложные полупроводниковые материалы объединяют по номеру группы Периодической системы элементов Д.И. Менделеева, к которой принадлежат компоненты соединения, и обозначают буквами латинского алфавита (A – первый элемент, B – второй и т.д.). Широкое применение получили соединения:
AIIIBIV – InSb, InAs, InP, GaSb, GaP, AlSb;
AIIBVI – ZnS, ZnSe, ZnTe, CdS, CdTe, HgSe, HgTe, HgS.
