- •Предмет химии твёрдого тела
- •2. Классификация кристаллических тел по симметрии кристаллов
- •Классификация решёток
- •3. Типы химических связей в кристаллах
- •Некоторые характеристики веществ при 298,16 к
- •4. Классификация твёрдых тел по особенностям зонной структуры
- •5. Элементы кристаллохимии твёрдых тел
- •Кубическая (гранецентрированная) (б)
- •Структуры и параметры элементарных ячеек некоторых металлов
- •Некоторые структуры с плотной упаковкой
- •Описание некоторых структурных типов
- •Типы соединений со стехиометрией ав
- •Некоторые соединения со структурой типа NaCl
- •Некоторые соединения со структурой сфалерита
- •Соединения со структурой вюртцита
- •Расчёт межатомных расстояний в некоторых простых структурах
- •Соединения структурного типа NiAs
- •Соединения структурного типа CsCl
- •Соединения структурного типа CdI2
- •6. Дефекты в кристаллах
- •7. Диффузия в твёрдых телах
- •Граница раздела
- •Через границу раздела Cu/CuZn
- •8. Гетерогенные и топохические реакции
- •8.1. Реакции окисления металлов и сплавов
- •8.2. Реакции восстановления железа из его оксидов
- •8.3. Реакции образования шпинелей
- •9. Аморфные твёрдые тела – стекла
- •Национальная металлургическая академия Украины
- •Редакционно-издательский отдел нМетАу
Классификация решёток
Типы решёток |
||||
По симметрии |
По Браве |
|||
1 |
2 |
|||
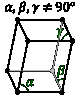
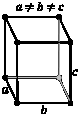
Триклинная Нет одинаковых углов; нет осей одинаковой длины. |
примитивная |
|
||
|
||||
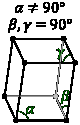
Моноклинная Два прямых угла; нет осей одинаковой длины |
примитивная |
базоцентрированная |
|
|
|
|
|||
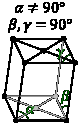
Ромбическая Три прямых угла; нет осей одинаковой длины |
примитивная |
базоцентрированная |
объёмноцентрированная |
гранецентрированная |
|
|
|
|
|
Продолжение табл. 2.1
1 |
2 |
|||
Гексагональная Две оси одинаковой длины в одной плоскости под углом 1200; третья ось под прямым углом |
|
базоцентрированная |
|
|
|
||||
Тригональная Три оси одинаковой длины; три равных угла, не равных 900 |
примитивная |
|
|
|
|
||||
Тетрагональная Две оси одинаковой длины и три угла равных 900 |
примитивная |
|
объёмноцентрированная |
|
|
|
|||
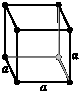
Кубическая Все оси одинаковой длины под прямым углом |
примитивная |
|
объёмноцентрированная |
гранецентрированная |
|
|
|
||
3. Типы химических связей в кристаллах
Многие физико-химические свойства кристаллических веществ определяются типом химической связи между образующими их частицами. Кристаллы подразделяют на молекулярные, ковалентные, ионные, металлические и смешанные.
Молекулярные кристаллы. Структурными единицами в кристаллах этого типа служат молекулы, связанные друг с другом силами Ван-дер-Ваальса или силами водородной связи.
Водородная связь – это особая разновидность и самая сильная молекулярная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя другими атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь, но также одну водородную связь.
Например, в кристалле льда каждая молекула воды тетраэдрично связана водородными связями с четырьмя ближайшими молекулами (рис.3.1). Водородная связь длиннее ковалентной, поэтому структура льда не плотная. Водородные связи, образуемые молекулами воды, обусловливают существование максимума плотности воды (при 3,980С), расширение воды при замерзании.
Н
О О
Н Н Н
О
Н Н Н Н
О О
Н Н Н
Рис. 3.1. Водородная связь
Ковалентные кристаллы. Структурными единицами в кристаллических решетках этого типа являются атомы одного или различных элементов, связь между которыми носит ковалентный характер и осуществляется по всем трем характеристическим осям. Ковалентные кристаллы сравнительно немногочисленны. В ковалентном кристалле невозможно выделить отдельную структурную единицу. Весь монокристалл по сути дела представляет собой одну гигантскую молекулу. Примерами кристаллов этого типа могут служить алмаз, кремний, германий, серое олово, а также кристаллы сложных веществ, таких, как кварц, карбид кремния, сульфид цинка, нитрид алюминия.
Ионные кристаллы. Кристаллические решетки ионных кристаллов состоят из чередующихся положительно и отрицательно заряженных ионов, между которыми действуют электрические силы притяжения. Правильно рассматривать весь ионный кристалл как одну гигантскую молекулу, в которой каждый ион испытывает значительное воздействие со стороны всех остальных ионов. Ионные кристаллы образуются при взаимодействии атомов, имеющих большую разность электроотрицательности.
Во многих ионных кристаллах наряду с электростатическими силами связи действуют еще ковалентные силы и силы Ван-дер-Ваальса. Вкладом последних можно пренебречь, однако наличие ковалентности в ионном кристалле вызывает определенные отклонения в его физико-химических свойствах, не объясняемые электростатической моделью. Наименьшее влияние ковалентности отмечено у галогенидов щелочных металлов. Примерами кристаллов, в которых преобладает ионный тип связи, могут быть NaCl, CaF2, KF.
В состав ионных соединений могут входить также сложные ионы, например NO3- и SO42-. В веществах ионной природы с многоатомными ионами геометрическая форма ионов вызывает искажение пространственной структуры кристалла.
На рисунке 3.2 приведены структуры ионных кристаллов NaCl и СаС03, сопоставление которых позволяет оценить степень искажения структуры кристалла, вызванную тригональной симметрией карбонат-иона.
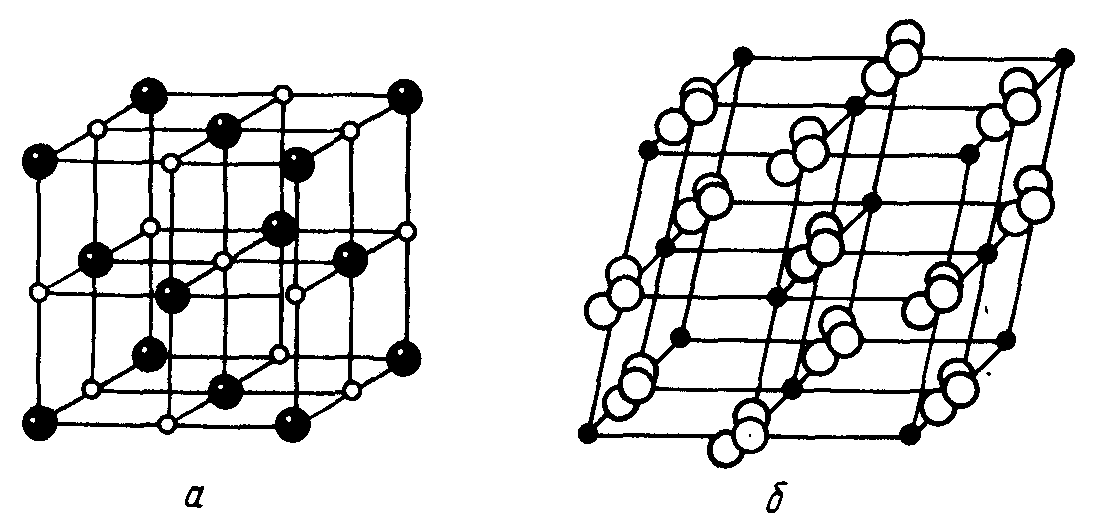
Рис. 3.2. Кристаллические решётки NaCl (a) и CaCO3 (б)
Металлические кристаллы. 98 известных химических элементов в твердом состоянии проявляют металлические свойства. К ним относятся все s-элементы, кроме водорода и гелия, все d- и f-элементы и часть р-элементов, а именно:
6 в группе щелочных металлов;
6 в группе щелочноземельных металлов;
38 в группе переходных металлов;
11 в группе лёгких металлов;
7 в группе полуметаллов;
14 в группе лантаноиды + лантан;
14 в группе актиноиды + актиний;
вне определённых групп бериллий и магний.
Металлическими свойствами обладают и многочисленные сплавы указанных элементов.
Во всех узлах кристаллической решётки металлических кристаллов расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы. В противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть.
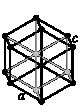
Большинство металлов образует одну из высокосимметричных решёток с плотной упаковкой атомов – кубическую объемно-центрированную, кубическую гранецентрированную либо гексагональную.
В кубической объемноцентрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемноцентрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решетке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
В таблице 3.1 приведены некоторые свойства металлов. Там же для сопоставления даны аналогичные свойства кристаллов других типов: алмаза (ковалентный), хлорида натрия (ионный) и серы (молекулярный).
Таблица 3.1