- •Кислотно-основное титрование. Нейтрализация сильной кислоты сильным основанием, изменение буферности системы, кривая титрования.
- •8.Определение константы диссоциации слабого протолита по кривой титрования.
- •9.Возможность и точность определения слабых кислот в водной среде методом потенциометрического титрования.
- •10.Нейтрализация смесей кислот. Возможность и точность раздельного определения кислот в водной среде.
- •11.Кислотно-основное титрование в неводных средах. Основные положения протолитической теории кислот и оснований. Влияние растворителя на силу протолитов, классификация растворителей.
- •12.Связь между константой автопротолиза растворителя и константами ионизации сопряженных кислот и оснований.
- •13.Факторы, определяющие выбор растворителя для титрования индивидуальных слабых протолитов и дифференциального анализа смесей протолитов.
- •14.Прямая потенциометрия. Металлические электроды в ионометрии. Мембранные (ионселективные) электроды и их классификация.
- •35.Амперометрическое титрование с двумя заполяризованными электродами
- •34.Амперометрическое титрование с одним заполяризованным электродом; форма кривых титрования; амперометрические индикаторы.
- •33.Прямая амперометрия и амперометрические датчики.
- •20.Газочувствительные и ферментные электроды.
- •32. Разностная и амальгамная полярография.
- •2.Потенциометрия. Потенциометрическое титрование, приемущества потенциометрической индикации конечной точки титрования.
- •3.Индикаторные электроды и их выбор для реакций нейтрализации, окислительно-востановительных, осаждения и комплексообразования.
- •16. Коэффициент селективности и методы его определения.
- •17. Устройство ионоселективных электродов. Электроды с кристаллическими мембранами (фторидлантановый электрод, электроды на основе сульфида серебра), гетерогенные мембраны.
- •Ионселективные электроды с жидкими мембранами и подвижными носителями.
35.Амперометрическое титрование с двумя заполяризованными электродами
В процессе амперометрического титрования после прибавления отдельных порций реактива отмечают силу тока при напряжении, соответствующем величине предельного тока. По этим данным строят кривую амперометрического титрования в координатах сила тока – объём титранта и графически находят точку эквивалентности.
При определениях по этому методу титрования с двумя индикаторными электродами в анализируемый раствор вводят два платиновых или иных инертных электрода под небольшим постоянным напряжением (0,01В) и в ходе титрования отмечают силу тока. До начала титрования сила тока между электродами или очень мала, или вообще не наблюдается, так как в отсутствие окислительно-восстановительной пары электродные процессы не происходят. Введение титранта вызывает появление в анализируемом растворе двух окислительно-восстановительных пар, причём до точки эквивалентности в растворе в заметных количествах будут находиться компоненты пары, образованной титруемым веществом, а после точки эквивалентности компоненты, образованные титрантом. Вид кривой титрования будет определяться, в основном, электрохимической обратимостью этих пар.
Если обе окислительно-восстановительные пары обратимы, то кривая титрования имеет вид(а).
Например, титрование железа (II) солью церия (IV): Fe2+ + Ce4+ = Fe3+ + Ce3+,
Добавление первых же порций соли Се4+ вызовет образование в растворе окислительно-восстановительной пары Fe3+/ Fe2+ и в цепи появится ток, так как восстановление Fe3+ на катоде и окисление Fe2+ на аноде вследствие высокой обратимости системы происходит при минимальной разности потенциалов. Сила тока будет возрастать, пока не прореагирует примерно половина Fe2+, затем начнёт уменьшаться и упадёт почти до нуля в точке эквивалентности. После точки эквивалентности на катоде будет восстанавливаться Се4+, а на аноде окисляться Се3+ и ток в цепи снова начнет возрастать.
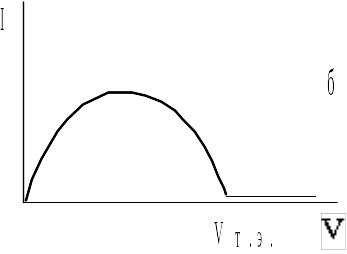
Если система, образуемая определяемым веществом, обратима, а титрантом – необратима, как, например, при титровании Fe2 перманганатом калия, кривая титрования до точки эквивалентности не будет отличаться первой кривой титрования, так как в обоих случаях сила тока в системе до точки эквивалентности контролируется электрохимически обратимой системой. Однако после точки эквивалентности возрастания силы тока не произойдёт, так как при этой разности потенциалов ион марганца Mn2+ на аноде окисляться не будет (рис.б)
Если титруется электрохимически необратимая система (например, титрование тиосульфата раствором иода), а титрант образует обратимую окислительно-восстановительную пару, то до точки эквивалентности тока не будет, а после точки эквивалентности он резко возрастает:
|
|
I
Vт.э. V Необратимая система |
Метод амперометрического титрования с двумя индикаторными электродами достаточно точен и чувствителен: он пригоден для анализа растворов с концентрацией определяемого вещества 10-5 моль/л и менее. В аппаратурном он проще, чем метод с одним индикаторным электродом. При титровании по этому методу часто отпадает необходимость в построении кривой титрования, так как точка эквивалентности может быть определена по резкому прекращению или появлению тока.