
- •1) Атомно-молекулярное учение. Основные законы: закон сохранения массы, постоянства состава, эквивалентов.
- •2) Строение атома. Электрон и его характеристики (гл.Квантовое число, орбитальное, магнитное).
- •3) Размещение электронов в атомах. Принцип Паули, правило Хунда.
- •4) Периодический закон и периодическая система элементов д.И.Менделеева. (s-, р- и d-элементы; периоды и группы; электронное строение атомов).
- •5) Основные свойства атомов (энергия ионизации, электроотрицательность, сродство к электрону, валентность, степень окисления)
- •6) Химическая связь. Типы химической связи (ковалентная – полярная и неполярная, ионная, металлическая, водородная, межмолекулярная).
- •7) Три основных свойства ковалентной связи (поляризуемость, насыщаемость, направленность).
- •8) Образование σ- и π- связей (показать графически).
- •9) Метод молекулярных орбиталей (ммо). Основные положения. Понятия связывающей и разрыхляющей молекулярных орбиталей( на примере образования молекулы или иона).
- •10) Молекулярные параметры (энергия связи, межъядерное расстояние, кратность связи).
- •11) Применение ммо к двухатомным гомоядерным молекулам. Энергетические диаграммы в2, с2, о2 .
- •12) Применение ммо к двухатомным гетероядерным молекулам.Примеры.
- •14) Внутренняя энергия системы. Тепловой эффект реакции. 1 закон термодинамики.
- •16) Закон Гесса. Примеры.
- •17) Стандартная теплота образования, сгорания.
- •18) Энтропия – мера хаотичности системы.
- •19) Изобарно-изотермический потенциал.
- •20) Кинетика химических реакций. Скорость химических реакций для гомогенных процессов.
- •21) Закон действующих масс для определения скорости химических реакций (для гомогенных и гетерогенных процессов).
- •22) Молекулярность и порядок химических реакций.
- •23) Влияние температуры и энергии активации на скорость химических реакций. Эмпирическое уравнение Вант-Гоффа.
- •24) Уравнение Аррениуса. Предэкспоненциальный множитель. Стерический фактор.
- •25) Химическое равновесие. Влияние различных факторов на сдвиг химического равновесия. Принцип ЛеШателье.
- •26) Катализ. Влияние катализатора на скорость химической реакции.
- •27) Растворы. Классификация растворов. Движущие силы образования растворов (δ s и δ g).
- •28) Растворы неэлектролитов. Закон Рауля, закон Дальтона, закон Генри.
- •29) Температуры кипения и замерзания разбавленных растворов.
- •30) Осмос. Осмотическое давление.
- •31) Растворы электролитов. Растворы слабых электролитов и сильных электролитов. Степень диссоциации.
- •32) Слабые электролиты. Константа диссоциации. Закон разбавления Оствальда. Диссоциация кислот и оснований.
- •33) Ионное произведение воды. Водородный показатель кислотно-основных свойств растворов.
- •34) Растворы сильных электролитов. Теория Дебая-Хюккеля. Уравнение Дебая-Хюккеля.
- •35) Основные классы неорганических веществ – оксиды, кислоты, соли, основания. Дать примеры каждого класса и химические реакции каждого класса. Примеры. Реакция нейтрализации (пример).
- •36) Окислительно-восстановительные реакции. Основные типы реакций (пример).
32) Слабые электролиты. Константа диссоциации. Закон разбавления Оствальда. Диссоциация кислот и оснований.
Важной характеристикой растворов слабых электролитов являются константы диссоциации. Рассмотрим в общем виде равновесную реакции диссоциации раствора слабого электролита.
НАп ↔ Н+ +Ап-
Кр = Кд =[ Н+] [Ап-]/ [НАп]
Если выразить равновесные концентрации через концентрацию слабого электролита (как С) и его степень диссоциации (α), то получим
Кд = Сα Сα / С (1-α) = Сα2/ (1-α) – Оствальд
Это соотношение называется законом разбавления Оствальда для очень слабыхэлетролитов, когда α<<1. Это соотношение упрощается
Кд = Сα2
α = √(Kd/C)
Н3РО4 = Н+ + Н2РО4- = 2Н+ + НРО4- = 3Н+ - РО4-
1 стадия 27%
2 стадия 0,15%
3 стадия 0,005%
33) Ионное произведение воды. Водородный показатель кислотно-основных свойств растворов.
Вода, являясь слабым электролитом и обычным растворителем, участвует в кислотно-основном равновесии растворенных в ней электролитов.Для воды константа диссоциации:

При столь малой константе диссоциации концентрация самой воды остается практически неизменной.
[H2
O]=
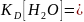
Отсюда произведение постоянных величин есть величина постоянная.
Численное произведение ионов на которое диссоциируется вода называется ионное произведение воды.

Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель, или рН. Водородным показателем называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе :

рН+рОН=14
34) Растворы сильных электролитов. Теория Дебая-Хюккеля. Уравнение Дебая-Хюккеля.
Принципиальное отличие сильных электролитов от слабых, что равновесие диссоциации полностью смещено вправо.
Н2SО4 = Н+ + НSО4- кислые соли
Константы диссоциации оказываются величиной неопределенной.
Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов. В связи с этим была предложена модель, которая легла в основу теории сильных электролитов. Основоположники: Дебай и Хюккель. 1. Электролит полностью распадается, но в сравнительно разбавленных растворах. С=0,01 моль/л
2. Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь каждый из этих ионов сольватирован. Это окружение называют ионной атмосферой.
При электростатистическом взаимодействии ионов противоположного знака необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется: она сгущается перед этим катионом и разряжается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящие действия движению катиона, тем выше концентрация и тем больше заряд ионов. В этих системах само понятие концентрация становится неоднозначным и должно заменяться активностью ионов. Для одно-однозарядного электролита общей формулой.
КatAn
Для электролитов активностью ионов выражается следующим образом:
 -коэффициент
активности катиона и аниона.
-коэффициент
активности катиона и аниона.
 -
аналитические концентрации катиона и
аниона.
-
аналитические концентрации катиона и
аниона.
Определить активности каждого иона в отдельности невозможно. Поэтому для одно-однозарядных электролитов пользуются средними геометрическими значениями активности и коэффициентом активности.


Коэффициент активности по Дебаю и Хюккелю зависит от температуры, диэлектрической проницаемости растворителя и ионной силой 1.
1-эта мера интенсивности электрического поля, создаваемого ионами в растворе. Дебаи и Хюккель предложили уравнение, связывающее 3 величины: заряд иона, ионная сила и коэффициент активности.

Ионная сила выражается след.уравнением:

Для однозарядного электролита ионная сила совпадает с концентрацией, но ионы в электролите имеющие разные заряды при одинаковой концентрации будут иметь разные ионные силы. Сопоставление свойств сильных электролитов можно проводить только тогда, когда ионные силы одинаковые. Небольшие примеси резко изменяют свойства электролита.
