
- •Лекция 1: введение в предмет ах. Основные термины и понятия.
- •Лекция 2. Пробоотбор и подготовка пробы к анализу.
- •Лекция 3. Основные разновидности химич-х методов анализа.
- •Лекция 4. Кислотно-основное взаимод-е. Теория кислот и основания.
- •Лекция 7. Комплексонометрическое титрование
- •Лекция 8.Ионно-электронный метод подбора стеохеметрических коэф-тов в ур-ях овр.
- •Лекция 9. Титриметрия
- •1.Способы выражения содерж-я вещ-ва в раствор-х:
- •2.Метрологическая оценка результатов измер-ий в анал-ой химии
Лекция 8.Ионно-электронный метод подбора стеохеметрических коэф-тов в ур-ях овр.
Распечатать, так как много уравнений ОВР!!!!!!! Решение Бруттто схемы!
ОВР относят те из них которых как минимум 1 вещ-во выступает в качестве донора электронов(отдает свои е) и как минимум 1 вещ-во в роле акцептора е-на,т.е. принимает электроны.Первое назыв-ют восстан-ем,второе-окислителем.
Любое уравнение которое мы получим,должно соот-ть 2 фундамент-м законам природы:1)закон охранения массы,2)закон сохранения заряда.
!!!В рамках любого ур-я полуреакц-й е-ны должны указываться в левой части равенства.
В молекул-м уравнении расстановка коэфф-ов в ОВР надо с тех веществ в отнош-е которых вы уверены,что они явл-ся исход-ми вещ-ми только окисл-восстан.реакций.И только потом остальных,к которой такой уверенности нет.
Брутто схема:1)ионно-электрон,2)итогово электронно-молек-е ур-е,3)подобрать стеохеметр.коэффиц-т в молек-м урав-ии
Лекция 9. Титриметрия
В основе титриметр-х измерений лежит определение колич-ва реагента пошедшего на реакцию с определ-мым вещ-вом.X+R(реагент(титрант),который имеет точную конц-ию и вступает в реак-цию)→Пр(продукт реакции).
В основе титриметр-их измерений лежит 4 типа реакций:1)кислотно-основное,2)ОВР,3)комплексообр-я,4)р-я осаждения.
Титрование-процесс постепенного прибавления титранта к определ-му вещ-ву.Титрование приводит до достижения стехиометрич.соотнош-й м/у колич-ом опред-го вещ-ва и реагентом.n(1/z*x)=n(1/z*R):n-количество,z-эквивалент,1/z-фактор эквивалентности.
Эквивалент-условная или реальная частица,которая может присоединять,высвобождать или быть каким-либо другим образом эквивалентной 1 протону водорода в случае кислотно-основ-го титров-я или 1 электрону в случае ОВР.M(1/z*x)масса эквив-та,которая рассчит-ся через массу вещ-ва=1/zкоэф-нтM(x)Напр:H2SO4 M(1/2*98)=49
п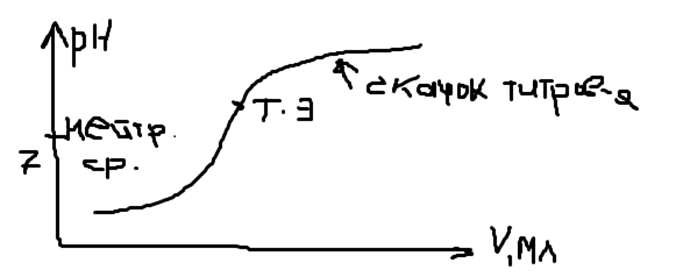 оказатель
св-ва системы.Кривая
титрования.кислотно-основная
рНкислоты>7
оказатель
св-ва системы.Кривая
титрования.кислотно-основная
рНкислоты>7
точка эквив-ти она соотв-ет: n(1/z*x)=n(1/z*R):
Концентрация С. С(1/ z*х)*V(x)=C(1/z*R)*V(R); С(1/ z*х)=C(1/z*R)*V(R)/V(x)
1.Способы выражения содерж-я вещ-ва в раствор-х:
1моль-кол-ва вещ-ва в котором содержится столько же,так назыв-х условных единиц,сколько их содержатся в 0,012кг С с массовым числом 12.
1моль-кол-ва вещ-ва с числом так называе-х условных единиц равным числу Авагадро.Под условными единицами,можно воспринимать все что угодно.
Молярная масса(масса 1 моля)-численно равна его молек-ой массе9углерод.единицах).Единица измерения-1 углеродн.Единица(дальтон)
Молярная концентрация(СM): С(М)=n(s)число молей раств-го вещ-ва/Vp-pa[ моль/л-1];[моль/дм-3]
Концентрация (С)-раст-го,способ какой-либо выражения содеож-я вещ-ва в растворе,предостав-ий собой отношение какого-либо параметра,характериз-го коли-во раств-го вещ-ва к какому либо параметру,характер-щему кол-во раст-ра или же образующ-го его раств-ля.
Массовая концентрация (Сm)-параметры о которых говорится в опред-ях,могут совпадать и могут отличаться.
Если параметры СM и Сm не совпадают,то использ-ся С.Если совпадают,то использ-ся специальные индексы:Cm=m(s)раств-го вещ-ва/Vраст-ра [г*л-1],[мг*л-1].Разновидность массовой концентрации с размерностью[г*мл-1]наз-ся титром,Т-обозн-ся.
Доля компонента:массовая,объемная,молярная доля компонента.ω(массовая доля)= m(s)масса раств-го вещ-ва/ mр-р=mi(s)/сумма mi %0-промиля(за1000),%-процент(за 100).ᵩ(объемная доля компонента)=V (s)/ Vрас-ра. α=n(s)/n р-ра.CM’(моляльная конц-я)=n(s)/mраств-ля.Разновидность конц-ии использ-ся в том случае,когда измерение колич-ва раств-го вещ-ва ведется вне изотермич.условиях,применяющиеся в темпер.раств-ра.C(N)нормальная конц-я=nэ(s)(число эквивалента)/Vр-ра [моль эквив*л-1][моль эквив.*дм-3]Под эквивалентом в общем случае понимают,какой-либо объект равноценный данному объекту в каком-либо определ-м соотнош-ии.аА+вВ→сС+дД,n=fэкв(фактор эквив)*nчисло молекул,fэкв(B)=b/a fэкв(C)=C/DЕсли не указана относит-я эквив-сть,то нельзя использ.нормальную концентр-ю.
