
- •Лекция 1: введение в предмет ах. Основные термины и понятия.
- •Лекция 2. Пробоотбор и подготовка пробы к анализу.
- •Лекция 3. Основные разновидности химич-х методов анализа.
- •Лекция 4. Кислотно-основное взаимод-е. Теория кислот и основания.
- •Лекция 7. Комплексонометрическое титрование
- •Лекция 8.Ионно-электронный метод подбора стеохеметрических коэф-тов в ур-ях овр.
- •Лекция 9. Титриметрия
- •1.Способы выражения содерж-я вещ-ва в раствор-х:
- •2.Метрологическая оценка результатов измер-ий в анал-ой химии
Лекция 4. Кислотно-основное взаимод-е. Теория кислот и основания.
Кисл-основ.взаим-е.
НА↔Н+ +А- (конц-я была выдвинута С.Аррениус)
В+Н+↔ВН+
Есть недостатки:1.) Na2CO3-сода, нет Н, если капнем финолфт-ин,то окрашив-ся.Теория не могла объяснить кислот-основ. св-в,в составе которых не было состава атома водорода.2)Н+ не содер-ся електрон. Трудно предст-ть себе возможность существ-я «голого»протона в раст-ре в силу исчезающ-х малых размеров этой частицы.3) ТЕОРИЯ С.Аррениуса фактически игнорир-ет возмож-ть участия раствор-ля в формир-ии кислотно-основных свойств вещ-ва. Усовершенств-ал и вышла ТЕОРИЯ Брэнстед-ЛОУРИ.В рамках допуск-лось,но эта была первая стадия.Во 2-ой стад-ии.В рамках теории предплаг-ся учет влияние природы раствор-ля на кислоно-основ-е взаимод-е. SH-молекула раствор-ля.
В рамках ТЕОРИИ Брэнстед-ЛОУРИ соедин-я можно считать кислотой,если :
НА+SH↔SH2+ + A- (K)
B+SH↔BH+ + S- (O); SH2+-лионий(лиос-растворять), S- лиат(отриц.заряж)
Одно и то же вещ-во может быть кислотой,а в других ион.Если вещ-во проявл-ет окисл и восст., то амфотерн-ое :H3PO4↔H+ +H2PO4-
H2PO4-↔H+ +HPO4 2-
HPO4 2-↔H+ +PO4 3-амфот-ое-3 подвижн-х протона.
В рамках теории понятия кислота и основ-е не явл-ся абсолютами,а при во многом зависят от природы раствор-ля.Пример:HCl,HNO3-сильн-е кислоты.
HCl+H2O↔H3O+ + Cl-
HNO3+H2O↔H3O+ катион лиония+ NO3- }в воде
H3O+ гидроксоний, ОН- гидроксид-анион
В жидком фтороводороде:
HCl+H2F2↔H2Cl+ +HF2-
HNO3+H2F2↔H2NO3+ +HF2
Оба основания проявляют св-во основания. 1-вода слабая кислота,2-вода сильная кислота.
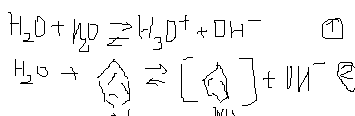
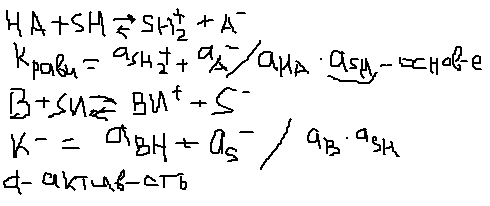 а-активсть,а=fкоэф.акт*c-конц.
а-активсть,а=fкоэф.акт*c-конц.
Растворителя больше,чем растворимого вещ-ва.
asH-постоянная
величина
![]()
Ка=aSH+a A-/aHA; pKa= -1lgKa-сила кислоты.
Кислоты:-сильные: <1(HCl,HNO3,HClO4);-умеренной силы 1-5 ,H2SO4 по 2 ступ;-слабые 5-10 ,CO2 H2SiO3 ;-очень слабые >10
Протолическая
способность растворителя.
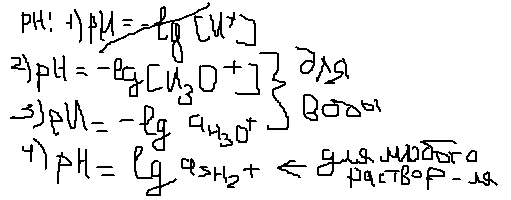
Как
определить какой раствор?
Раствор:нейтр,щелочн,кислый.

Лекция 5. Кислотно-основное титрование. Титрование одноосновной и слабой кислоты.
(отксерить лекцию, так как там сплошные формулы)
Требования к выбору индикатора: -индик-р должен обладать контрастным переходом окраски,-зона перехода окрасок должна быть меньшим,-естеств-е условия,эти окраски должны быть высокой степени светопоглощ-я видимой области поглощ-я.
Лекция 6. Редоксетрическое«окислительно-восстановительн» ОВ титрование.
(отксерить лекцию, так как там сплошные формулы)
Вещество отдающее электроны наз-ют восстан-ем,вещ-во принимающ-ее-окислит-ем.
Важнейшие методы редокс-метрического титрования : 1. Перманганатометрия: MnO4- +8H+ +5e→Mn+2+4H2O Достоинство метода:как правило с его помощью можно провести прямое титрование.Этот процесс протекает стехиометрически.!Здесь не нужен спец-ый индикатор.Недостатки:раствор титранта нельзя готовить по точной навеске.Раствор стабилен при хранениии. MnO4- +Н2О→ MnО2+О2+ОН-. 2. Дихрометрия: Сr2O72-+14H+ + 6e→2Cr+3+7H2O Только обратное титрование.Протекает намного сложнее.Достоинства метода:относ-ся недостатки перманганата, Недостатки:относ-ся достоин-ва перманг-та.Можем взвесить по точной навеске, нужен индикатор. 3.Целеметрия: Ce(SO4)2 ,Ce4+ +e→Ce+3 Его можно готовить только точной навеской.Можно провести прямое титрование.Недост:дефицитность этого вещ-ва.4.KBrO3 BrO3- +6H+ + 6e→Br- +3H2O Дост-во:перманг. и дихрометр. Потенциал ЕОХ/ред=1,60В.Раст-р можно готовить по точной навечке.Недостаток:нужен спец-ый индикатор.
