
- •Е.А.Кузнецова
- •302020, Г.Орёл, ул. Наугорское шоссе, 29
- •Содержание
- •История развития микробиологии
- •Часть I краткая характеристика микроорганизмов и основные методы микробиологических исследований
- •Глава 1
- •Бактерии
- •Мицелиальные грибы
- •Глава 2
- •Ведение лабораторных записей
- •Глава 3
- •Глава 4
- •Принципы составления сред для культивирования микроорганизмов
- •Условия культивирования микроорганизмов
- •Аэрация
- •Способы культивирования аэробных микроорганизмов
- •Способы культивирования анаэробных микроорганизмов
- •Температура
- •Глава 5
- •Выделение чистой культуры из одной клетки
- •Определение чистоты выделенной культуры
- •Часть 2 лабораторный практикум
- •Общие сведения
- •1.3.Практическая часть.
- •1.3.1.Знакомство с правилами работы с микроскопом.
- •1.3.2.Исследование живых клеток микроорганизмов .
- •1.3.2.1.Методика выполнения работы.
- •1.3.2.2. Оформление работы.
- •1.4. Контрольные вопросы.
- •Общие сведения
- •2.3.Практическая часть.
- •2.3.1. Методика выполнения работы.
- •2.3.2. Оформление работы.
- •Контрольные вопросы.
- •Общие сведения
- •3.3.Практическая часть.
- •3.3.1.Окраска микроорганизмов по Грамму.
- •3.3.1. 1.Методика выполнения работы
- •3.3.1.2. Оформление работы.
- •3.3.2. Выявление кислотоустойчивости у бактерий.
- •3.3.2. 1.Методика выполнения работы
- •3.3.2.2. Оформление работы.
- •3.3.3. Негативный способ окраски препаратов.
- •3.3.3. 1.Методика выполнения работы
- •3.3.3.2. Оформление работы.
- •Контрольные вопросы.
- •Общие сведения
- •4.3.Практическая часть
- •4.3.1. Окраска включений клеток микроорганизмов.
- •4.3.1. 1.Методика выполнения работы
- •4.3.1.2. Оформление работы.
- •4.3.2.Окраска спор у бактерий.
- •4.3.2. 1.Методика выполнения работы
- •4.3.1.2. Оформление работы.
- •Контрольные вопросы.
- •Общие сведения
- •5.3. Практическая часть
- •5.3.1.Методика выполнения работы
- •5.3.2. Оформление работы.
- •5.4.Контрольные вопросы.
- •Общие сведения
- •6.3. Практическая часть
- •6.3.1.Методика выполнения работы
- •6.3.2. Оформление работы.
- •. Контрольные вопросы.
- •Общие сведения
- •7.3. Практическая часть
- •7.3.1.Методика выполнения работы
- •7.3.2. Оформление работы.
- •Контрольные вопросы.
- •Общие сведения
- •8.3. Практическая часть
- •8.3.1.Методика выполнения работы
- •8.3.2. Оформление работы.
- •8.4.Контрольные вопросы
- •Общие сведения
- •9.3. Практическая часть
- •9.3.1.Методика выполнения работы
- •9.3.2. Оформление работы.
- •9.4.Контрольные вопросы
- •Общие сведения
- •Практическая часть
- •10.3.1.Методика выполнения работы
- •10.3.2. Оформление работы.
- •10.4.Контрольные вопросы
- •Практическая часть
- •11.3.1.Методика выполнения работы
- •Практическая часть
- •12.3.1.Методика выполнения работы
- •12.3.2. Оформление работы.
- •12.4.Контрольные вопросы
- •Практическая часть
- •13.3.1.Методика выполнения работы
- •13.3.2. Оформление работы.
- •13.4.Контрольные вопросы
- •Практическая часть
- •14.3.1.Методика выполнения работы
- •14.3.2. Оформление работы.
- •14.4.Контрольные вопросы
- •Общие сведения
- •Практическая часть
- •15.3.1.Методика выполнения работы
- •15.3.2. Оформление работы.
- •15.4.Контрольные вопросы
- •Общие сведения
- •Практическая часть
- •16.3.1.Методика выполнения работы
- •16.3.2. Оформление работы.
- •Контрольные вопросы
- •Рекомендуемая литература
- •Приложение Рецепты приготовления некоторых красителей и растворов.
- •Рекомендуемая литература
Глава 2
МИКРОБИОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ И ПРАВИЛА РАБОТЫ В НЕЙ
Микробиологи имеют дело с популяциями (культурами) микроорганизмов, состоящими из миллионов особей. Культуру, содержащую микроорганизмы одного вида, называют чистой. Если в культуре содержится более одного вида микроорганизмов, она носит название смешанной. В микробиологической практике используют главным образом чистые культуры микроорганизмов. Ввиду того что в воздухе и на поверхности предметов (на столах, инструментах, одежде), а также на руках, волосах и т. д. всегда имеется большое количество разнообразных микроорганизмов, следует постоянно заботиться о сохранении чистоты изучаемых культур. Требование чистоты культур в значительной степени определяет специфику устройства микробиологической лаборатории и правила работы микробиолога.
Кроме основного рабочего помещения лаборатория имеет стерилизационную, где размещены автоклавы и сушильные шкафы, бокс, моечную, холодильную комнату, помещение для хранения культур и т. д.
Бокс служит для пересевов микроорганизмов и представляет собой небольшую изолированную комнату, разделенную перегородкой на две части. Вход в рабочее помещение бокса осуществляется через тамбур с раздвижной дверью, что исключает резкое перемещение воздуха и, следовательно, занесение извне посторонней микрофлоры. Оборудование бокса состоит из стола, стула, газовой горелки и бактерицидной лампы, укрепленной в специальном штативе или смонтированной на потолке бокса. Удобно иметь в боксе подсобный стол, на котором размещают необходимые во время работы предметы.
Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов. Спирты весьма эффективны в отношении вегетативных форм микроорганизмов. Названные спирты можно также применять для дезинфекции рук. В тех случаях, когда поверхность стола имеет водоотталкивающее покрытие, особенно удобен лизол. Поверхность рабочего стола можно дезинфицировать и ультрафиолетовыми лучами. При этом следует учитывать, что бактерицидное действие лучей тем выше, чем ближе облучаемая поверхность к источнику излучения.
В лаборатории не разрешается курить, есть, пить. Работать следует в халатах.
В лаборатории микроорганизмы выращивают на плотных и в жидких питательных средах, которые разливают в пробирки, колбы, матрацы и чашки Петри (рис. 25). Посуду и питательные среды предварительно стерилизуют. Способы приготовления питательных сред и стерилизации подробно описаны в следующей главе пособия.
Внесение клеток микроорганизмов в стерильную среду называется посевом, или инокуляцией. Посев микроорганизмов требует соблюдения определенных правил, которые необходимо выполнять, чтобы предохранить исследуемую культуру от загрязнения посторонними микроорганизмами. Перед посевом следует тщательно надписать на пробирке (колбе или чашке Петри) название микроорганизма и дату посева. Надпись делают чернилами по стеклу или на специально наклеенной этикетке.
Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей или иглой (рис. 26), если микроорганизмы выращены на плотной среде. В том случае, когда нужно приготовить препарат или пересеять культуры микроорганизмов, выросшие в жидкой питательной среде, лучше пользоваться не петлей, а стерильной пипеткой. Бактериологические петли и иглы делают, используя тонкую проволоку из платины или нихрома, которую закрепляют в металлическом держателе или впаивают в стеклянную палочку. Диаметр бактериологической петли – 4 – 5 мм.
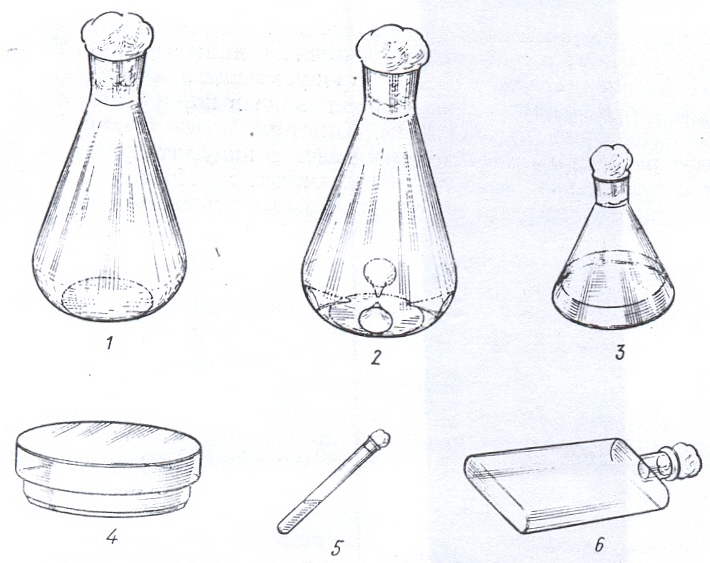
Рисунок 25. Посуда для культивирования микроорганизмов: 1 – качалочная колба; 2 – качалочная колба с отбойниками; 3 – коническая колба; 4 – чашка Петри; 5 – пробирка; 6 – матрац

Рисунок 26. Бактериологическая петля (1) и бактериологическая игла (2)
Бактериологическую петлю (иглу) перед взятием клеток микроорганизмов стерилизуют. Для этого проволоку накаливают докрасна в пламени горелки и одновременно обжигают примыкающую к петле часть держателя, которая будет вводиться внутрь сосуда, содержащего микроорганизмы. Петлю рекомендуется держать в пламени горелки почти вертикально, чтобы проволока была равномерно раскалена на всем протяжении. При прокаливании необходимо помнить, что наивысшая температура развивается в верхней и периферической частях пламени (рис. 27), поэтому не следует опускать петлю непосредственно к горелке. Сразу же после стерилизации петлю (иглу) вводят в сосуд с микроорганизмами. Чтобы не повредить клетки микроорганизмов, петлю (иглу) вначале охлаждают, прикасаясь ею к внутренней поверхности сосуда или к питательной среде, свободной от клеток микроорганизмов, и только после этого захватывают небольшое количество микробной массы.

Рисунок 27. Значение температуры (в градусах Цельсия) в разных участках пламени газовой горелки
Отбор клеток микроорганизмов, выращенных на плотной среде в пробирке, осуществляют следующим образом (рис. 28). Пробирку с культурой берут в левую руку так, чтобы поверхность питательной среды с налетом выросших микроорганизмов была обращена кверху и хорошо видна. Пробирку держат в горизонтальном или несколько наклонном положении. В правую руку берут петлю так, как держат карандаш, и прокаливают ее в пламени горелки. Затем, не выпуская петли, мизинцем и безымянным пальцем правой руки прижимают ватную пробку к ладони, вынимают ее из пробирки и держат так во время последующих манипуляций. Края открытой пробирки с культурой микроорганизмов обжигают в пламени горелки и после этого вводят в пробирку стерильную петлю. Взяв небольшое количество микробной массы с поверхности субстрата, вынимают петлю из пробирки, следя за тем, чтобы переносимый материал не касался стенок или краев пробирки.
Горлышко пробирки снова обжигают в пламени горелки, затем обжигают ватную пробку и закрывают ею пробирку. Если конец ватной пробки загорится, то не следует бросать пробку. Ее нужно быстро ввести в пробирку, где вата сама потухнет. Ни в коем случае нельзя дуть на загоревшуюся пробку, так как это только усилит горение. Если в момент пересева ватная пробка упадет на стол или на пол, то не следует снова вставлять ее в пробирку. Нужно взять новую стерильную пробку и начать всю операцию заново. Закрытую ватной пробкой пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления препарата или для пересева культуры в свежую среду.
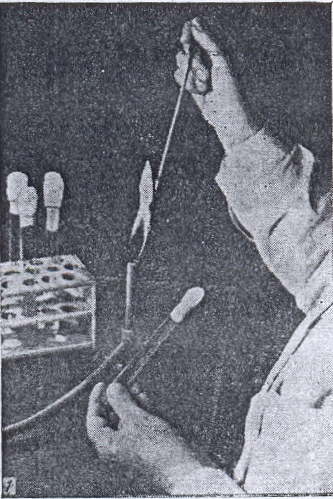
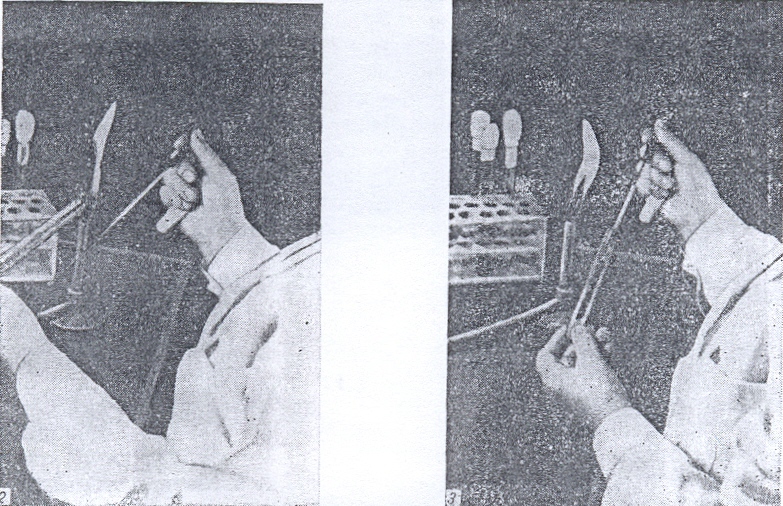
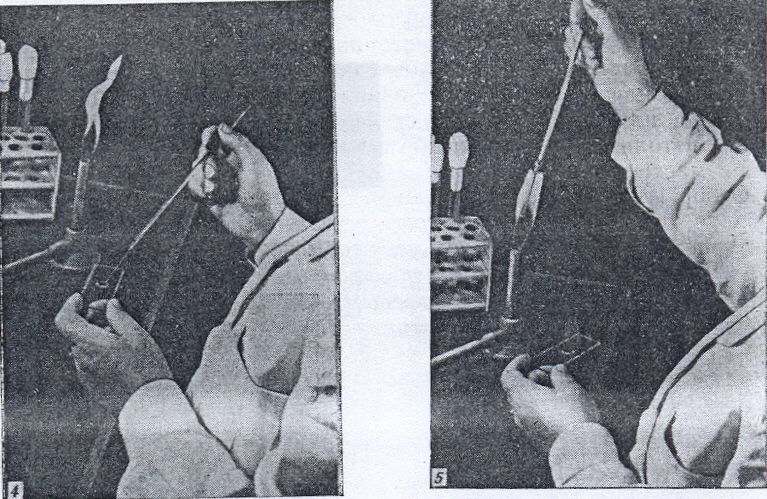
Рисунок 28. Способ стерильного извлечения микроорганизмов с поверхности плотной среды
Если культуру пересевают на скошенную агаризованную среду, то петлю вводят в пробирку до конца и, слегка касаясь ею поверхности агара, проводят снизу вверх либо зигзагообразную, либо прямую черту - штрих. При этом стараются не повредить поверхность плотной среды. В случае пересева в жидкую среду (в колбы или пробирки) петлю с микробной массой погружают непосредственно в среду. Оставшиеся на петле после пересева или приготовления препарата клетки микроорганизмов тщательно сжигают в пламени горелки. Прокаливание петли в этом случае начинают с участка проволоки, примыкающего к кольцу, для того, чтобы микробная масса, оставшаяся на петле, подсохла. Затем петлю переводят в вертикальное положение и прокаливают докрасна. Такой порядок стерилизации петли необходим потому, что при быстром нагревании влажной микробной массы происходит ее разбрызгивание и образуется аэрозоль, загрязняющий воздух. Только после прокаливания петлю можно положить на место.
Из жидкой среды клетки берут следующим образом: пипетку за верхний конец вынимают из бумаги или пенала, в которых она стерилизовалась, и вводят в пробирку или колбу с культурой, соблюдая все предосторожности, описанные выше (рис. 29). Отбирать жидкую культуру пипеткой можно с помощью резиновой груши. Использованную пипетку следует немедленно перенести в дезинфицирующий раствор, например 3-5% -ный водный раствор фенола или 2% -ный раствор хлорамина, не касаясь ею окружающих предметов.
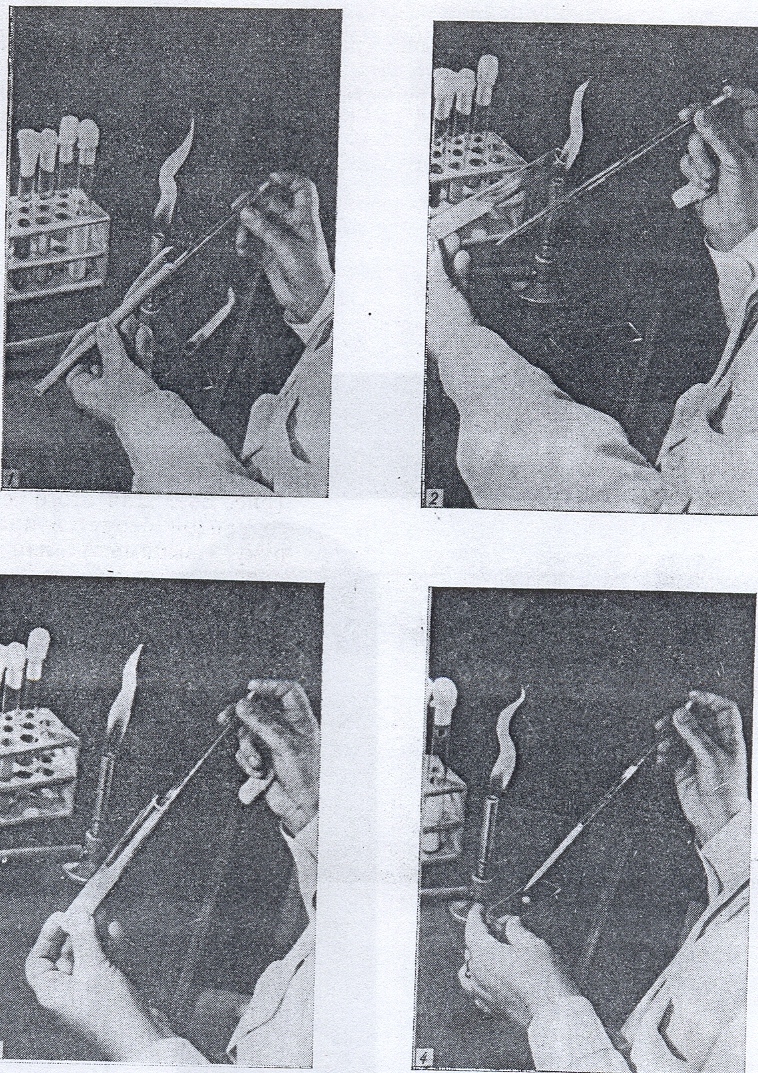
Рисунок 29. Способ стерильного извлечения микроорганизмов из жидкой среды
Когда необходимо провести рассев микроорганизмов из жидкой питательной среды на поверхность плотной среды в чашке Петри, поступают следующим образом. Расплавленную на кипящей водяной бане стерильную питательную среду, содержащую агар или желатину, разливают в стерильные чашки Петри (рис. 30).

Рисунок 30. Разлив стерильной среды в чашки Петри
Для этого сосуд со средой берут в правую руку, вынимают из него пробку, зажимая ее мизинцем и безымянным пальцем левой руки. Затем обжигают горло сосуда в пламени горелки и, приоткрыв большими средним пальцами левой руки крышку чашки Петри, быстро наливают в чашку расплавленную среду в таком количестве (10-15 мл), чтобы дно чашки было полностью покрыто. Крышку тотчас закрывают и чашку оставляют на горизонтальной поверхности до тех пор, пока не застынет среда. Для посева приоткрывают крышку чашки Петри и на поверхность плотной среды наносят каплю или «петлю» жидкой культуры, которую осторожно распределяют стеклянным стерильным шпателем (шпатель Дригальского) либо петлей.
Все описанные манипуляции следует проводить около пламени горелки (но не в пламени), по возможности быстро, чтобы не загрязнить культуру посторонними микроорганизмами. Не рекомендуется делать резкие движения и ходить около лица, работающего с чистой культурой, так как движение воздуха увеличивает вероятность случайного ее загрязнения. После пересева пробирку или другие сосуды, в которых выращивают микроорганизмы, помещают в термостаты, где с помощью терморегуляторов поддерживается постоянная температура. Неаккуратное обращение с культурами микроорганизмов приводит к возникновению бактериального аэрозоля.
