
- •Инструкция по технике безопасности
- •Порядок проведения работы о составления отчета
- •Погрешности измерений
- •Лабораторная работа №1 Измерение атмосферного давления
- •Общие положения
- •Проведение эксперимента и обработка результатов
- •Порядок выполнения работы и обработка результатов
- •Контрольные вопросы и задания
- •Лабораторная работа № 4 Измерение удельной теплоты плавления льда
- •Лабораторная работа № 5 Измерение удельной теплоемкости и удельной теплоты плавления парафина.
- •Порядок выполнения работы
- •3 Предохранительный клапан; 4 манометр; 5,8 термометры; 6,7 вентили; 9 калориметр; 10 весы
- •Контрольные вопросы
- •Библиографический список
Порядок выполнения работы
1. Опустить в нагреватель испытуемое тело. Включить нагреватель.
2. Пока тело нагревается до температуры T1 кипения воды, наполнить водой водомерный стакан (200 см3) и вылить ее в стакан калориметра. По термометру определить начальную температуру Т0 воды и калориметра.
3. После того как вода в нагревателе будет кипеть не менее 5 мин, отключить нагреватель, перенести за нить исследуемое тело в калориметр и быстро закрыть его.
4. По термометру калориметра следить за ростом температуры воды и записать в таблицу ее максимальное значение T.
5. Вылить воду из стакана калориметра и охладить его под струёй воды.
6. Действия, перечисленные в пп. 1-5, повторить с каждым из тел.
7. Определить теплоемкость с каждого из тел и результаты занести в таблицу.
8. По расчетной формуле найти изменение энтропии ∆S для каждого из тел и записать в таблицу. Вычислить погрешность метода измерения для самого легкого тела (максимальную погрешность).
9. По данным таблицы построить график зависимости ∆S=f(с).
Исследуемое тело |
Fe 0,05 кг |
F0 0,1 кг |
Fe 0,15 кг |
Fe 0,2 кг |
Al 0,05 кг |
Латунь 0,05 кг |
Т(К) |
|
|
|
|
|
|
С(Дж/К) |
|
|
|
|
|
|
∆S(Дж/К) |
|
|
|
|
|
|
Контрольные вопросы и задания
1. Что такое обратимые и необратимые процессы?
2. Охарактеризуйте энтропию и ее изменение.
3. Что такое термодинамическая вероятность состояния (статистический вес).
4. Статистический смысл изменения энтропии.
5. Первый закон термодинамики.
6. Вывод рабочей формулы данной работы.
7. Второй закон термодинамики и его статистический смысл.
Лабораторная работа № 7 Определение влажности насыщенного водяного пара
и его параметров состояния
Цель работы
Ознакомление с одним из методов определения влажности насыщенного водяного пара и его параметров состояния. Закрепление знаний по разделу курса «Термодинамические свойства воды и водяного пара».
Экспериментальная установка
Экспериментальная установка состоит из парового котла 2, оборудованного манометром 4, термометром 5 и предохранительным клапаном 3, калориметра 9 и весов 10 до установления стационарного режима парообразования в котле пар выпускают в атмосферу через вентиль 6. Подогрев воды в котле осуществляется с помощью электроплиты 1.
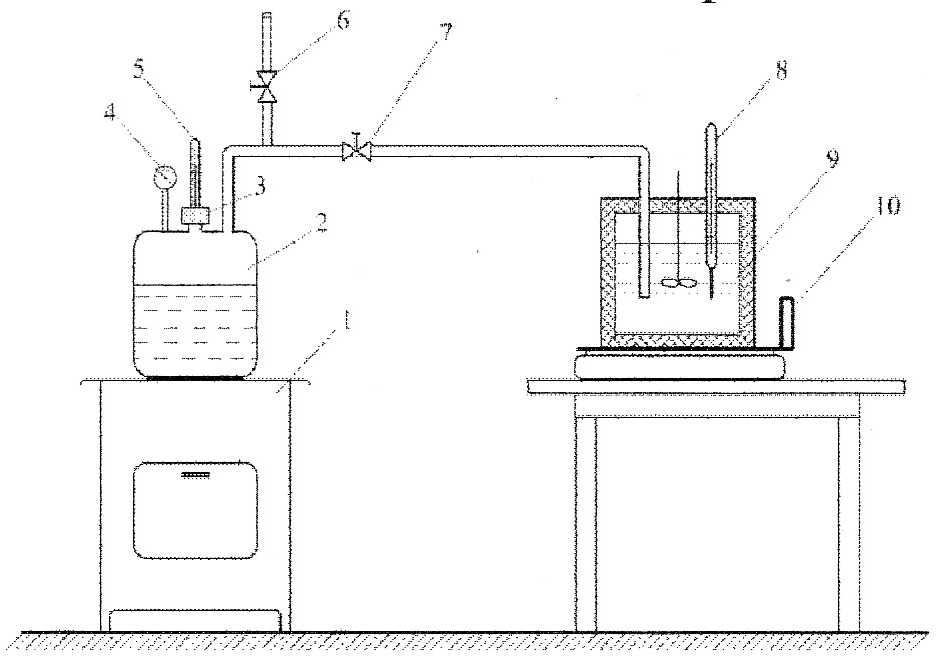
Рис. 7.1.Схема экспериментальной установки:1 электроплита; 2 паровой котел;
3 Предохранительный клапан; 4 манометр; 5,8 термометры; 6,7 вентили; 9 калориметр; 10 весы
Проведение эксперимента и обработка результатов
Воду в котле 2 нагреваем до кипения. До установления режима образования насыщенного водяного пара, пар направляется в атмосферу через вентиль 6 мимо калориметра при закрытом вентиле 7. После установления режима насыщенный водяному пар через паропроводящую линию с вентилем 7 при закрытом вентиле 6 направляется в калориметр 9, где водяной пар отдает воде теплоту парообразования, нагревая ее. Для измерения температуры в калориметре служит термометр 8. Калориметр 9 установлен на весах 10, на которых фиксируется масса калориметра в начале эксперимента, когда пар еще не подается в калориметр, и в конце эксперимента, кода в калориметре сконденсировался пар, подаваемый в него. Так определяется масса сконденсированного пара. Все полученные в результате эксперимента данные записываются в журнал наблюдений.
Показания манометра |
Показания термометра |
Масса воды в калориметре до эксперимента М1, кг |
Масса воды в калориметре после эксперимента М2, кг |
Температура воды в калориметре в начале эксперимента t1, °С |
Температура воды в калориметре после эксперимента t1, °С |
|
|
|
|
|
|
Составляем уравнение теплового баланса калориметра
(М2-М1)hx=Qк+Qтр+М2h2-М1h1.
Количество
тепла, полученное калориметром,
Qк=МкСк(t2-t1),
где
Мк -
масса калориметра, кг; Ск=0,46
кДж/кг - теплоемкость калориметра,
количество тепла, полученное пароподводящей
трубкой, считаем равной
нулю, из-за
небольшой длины трубки.
Из формулы
определим энтальпию поступающего в
калориметр пара:
![]() ,
где
h1
и h2
— энтальпии воды, взятые при температуре
по таблицам водяного пара. Степень
сухости х выразим из формулы
,
где
h1
и h2
— энтальпии воды, взятые при температуре
по таблицам водяного пара. Степень
сухости х выразим из формулы
![]() ,
где
h'
- энтальпия кипения воды, кДж/кг, h''-
энтальпия сухого насыщенного пара,
кДж/кг, определяем по таблицам водяного
пара. Определяем влажность водяного
пара (1-х). Затем определяем остальные
параметры состояния влажного пара.
,
где
h'
- энтальпия кипения воды, кДж/кг, h''-
энтальпия сухого насыщенного пара,
кДж/кг, определяем по таблицам водяного
пара. Определяем влажность водяного
пара (1-х). Затем определяем остальные
параметры состояния влажного пара.
