
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
§ 6. Изменение уровня жидкостей в капиллярах.
В результате смачивания водой стеклянной капиллярной трубки образуется искривленная поверхность – мениск. Давление под этой поверхностью р понижено по сравнению с давлением р0 у плоской поверхности. В результате возникает выталкивающая сила, поднимающая жидкость в капилляре до тех пор, пока вес столба не уравновесит действующую силу. Поскольку объем жидкости обусловлен кривизной, можно предположить, что высота подъема тем больше, чем больше кривизна мениска, возрастающая по мере утончения просвета трубки.
Рассмотрим состояние равновесия двух объемных фаз α (газ) и β (жидкость), разделяемых искривленной поверхностью в форме сферического сегмента.
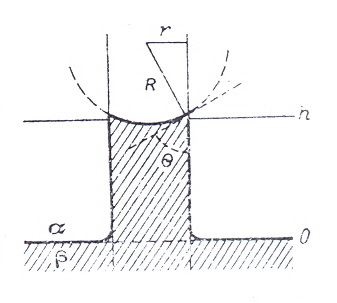
Равновесное состояние капиллярного поднятия жидкости: h – высота поднятия жидкости, 0 – нулевой уровень, R – радиус кривизны мениска, r – радиус трубки, Θ – краевой угол.
На нулевом уровне, отвечающем плоской поверхности, давление в обеих фазах в состоянии равновесия одинаково и равно р0 как внутри, так и снаружи трубки. На уровне h мениска давление pβ в фазе β меньше, чем на нулевом уровне в той же фазе, на величину гидростатического давления столба жидкости высотой h.
Это давление равно:
![]() .
.
Поэтому
![]() 4.3.1
4.3.1
Аналогично
![]() 4.3.2
4.3.2
Тогда для
![]() получим:
получим:
![]() .
4.3.3
.
4.3.3
В соответствии с
геометрическим построением данного
рисунка можем показать, что
![]() .
4.3.4
.
4.3.4
На основе уравнений 4.2.6, 4.3.3 и 4.3.4 получим уравнение Жюрена:
![]() ,
,
![]() ,
,
![]() .
4.3.5
.
4.3.5
Если α – пар или воздух, то ρβ » ρα, и величиной ρα можно пренебречь:
![]() 4.3.6
4.3.6
В случае несмачивания cosΘ < 0 и в соответствии с уравнением 4.3.5 h < 0, т.е. уровень жидкость должен опускаться (например, ртуть в стеклянном капилляре).
В случае полного смачивания (cosΘ = 1) получается упрощенное выражение, часто используемое на практике при небольших краевых углах:
![]() .
4.3.7
.
4.3.7
Из уравнений 4.3.5 – 4.3.7 видно, что чем меньше r, тем больше высота поднятия.
Для воды:
r = 1 мм, h = 1,5 см;
r = 1 мкм, h = 15 м;
r = 0,1 мкм, h = 150 м;
r = 1 нм, h = 15 км.
Капиллярное поднятие глубинных вод в грунтах и почвах обеспечивает существование растительного покрова Земли. Для предотвращения высыхания почвы применяются агротехнические мероприятия (например, боронование) с целью разрушения капиллярных каналов поверхностного слоя почвы.
§ 7. Химический потенциал и давление пара у искривленных поверхностей.
Рассмотрим малую сферическую каплю жидкой фазы α в фазе пара β. Используя уравнение для потенциала Гиббса для объемной фазы α при постоянных p и T, запишем:
![]() .
4.4.1
.
4.4.1
![]() ,
,
![]() ;
;
![]() ,
,
![]() .
.
Отсюда находим интересующую нас производную
![]() ,
4.4.2
,
4.4.2
где
![]() – парциальный мольный объем i-го
компонента.
– парциальный мольный объем i-го
компонента.
В процессе образования кривизны в однокомпонентной (i=1) двухфазной (α, β) системе при T, s и ni = const получим:
![]() 4.4.3
4.4.3
![]() 4.4.4
(см.§3)
4.4.4
(см.§3)
Подставляя 4.4.4 в 4.4.3, получим:
![]() ,
4.4.5
,
4.4.5
в первом приближении можно считать постоянной.
Так как для воды при r = 10–7 м и σ = 73∙10–3 Н/м можно найти p = 1,5 МПа (15 атм). Эта величина мала по сравнению с внутренним давлением воды (≈103 МПа), и поэтому справедливо допущение, что в процессе искривления поверхности дополнительного сжатия жидкости не происходит.
Проинтегрируем
выражение 4.4.5 в пределах от плоской
поверхности (радиус r=![]() )
до искривленной поверхности (радиус
r).
вынесем за знак интегрирования, т.к.
считаем ее постоянной.
)
до искривленной поверхности (радиус
r).
вынесем за знак интегрирования, т.к.
считаем ее постоянной.

![]() ,
4.4.6
,
4.4.6
где
![]() –
значение
–
значение
![]() вещества у плоской поверхности.
вещества у плоской поверхности.
Из уравнения 4.4.6
следует, что![]() в капле выше, чем у плоской поверхности.
Но в состоянии равновесия
в капле выше, чем у плоской поверхности.
Но в состоянии равновесия
![]() ,
тогда, относя в уравнении 4.4.6 левую часть
к пару, а правую – к жидкости, можно
записать для идеальной системы
,
тогда, относя в уравнении 4.4.6 левую часть
к пару, а правую – к жидкости, можно
записать для идеальной системы
![]() .
4.4.7
.
4.4.7
Над плоской поверхностью
![]() .
4.4.8
.
4.4.8
Подставим 4.4.7 и 4.4.8 в выражение 4.4.6:
![]() ,
4.4.9
,
4.4.9
![]() 4.4.10
4.4.10
Уравнение 4.4.10 называется уравнением Томсона (лорда Кельвина). Оно показывает, что давление насыщенного пара над каплей будет тем больше, чем больше σ и меньше радиус капли r.
Например, для воды при изменении радиуса от 10–5 см до 10–6 см давление увеличивается на 1 %. Это следствие уравнения Томсона (Кельвина) позволяет предсказать наблюдаемое явление изотермической перегонки, заключающееся в испарении малых капель и конденсации пара на более крупных каплях, а также на плоской поверхности.
Над вогнутым
мениском жидкости
![]() В этом случае радиус кривизны меняет
знак, и для сферического мениска
получается аналогичное уравнение
В этом случае радиус кривизны меняет
знак, и для сферического мениска
получается аналогичное уравнение
![]() .
4.4.11
.
4.4.11
