
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
§ 4. Смачивание
Смачивание – явление самопроизвольного растекания капли на твердой поверхности. При этом явлении σтг > σтж.
Процесс растекания останавливается, когда σжг становится соизмеримо со значением σтг — σтж. При неограниченном растекании σтг — σтж > σжг.
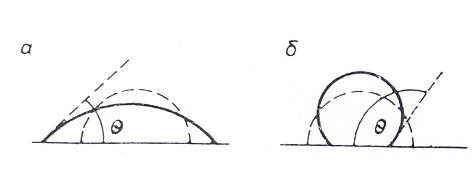
Рис. . Краевой угол смачивания: а) смачивание, б) несмачивание (пунктиром обозначена исходная капля).
Мерой смачивания является равновесный краевой угол Θ – угол между твердой поверхностью и касательной в точке соприкосновения трех фаз.
Условились считать угол Θ в сторону жидкой фазы.
Уравнение, определяющее условие смачивания (закон Юнга) имеет вид
![]() 4.1.1
4.1.1
Из анализа уравнения 4.1.1. следует:
σтг > σтж, cosΘ > 0, Θ < 90o – смачивание
σтг < σтж, cosΘ < 0, Θ > 90o – несмачивание
σтг = σтж, cosΘ = 0, Θ = 90o
Часто величины σтг и σтж неизвестны, поэтому рассматривают работу молекулярных сил.
Когезия (слипание) – явление, которое вызывают силы, действующие между молекулами внутри фазы.
Адгезия (прилипание) – явление, которое вызывают силы, действующие между молекулами, находящимися в разных фазах.
Работа когезий (Wc) – работа, необходимая для разрыва однородной объемной фазы.
![]() 4.1.2.
4.1.2.
(цифра 2 – вместо одной поверхности получаются 2 поверхности)
Работа адгезий (Wa) – работа разрыва межфазного поверхностного слоя. В результате этой работы образуются две новые поверхности, и исчезает исходная межфазная граница.
![]()
![]() 4.1.3
4.1.3
Из уравнений 4.1.1. и 4.1.3. следует уравнение Дюпре:
![]() 4.1.4
4.1.4
По уравнению 4.1.4. Wa можно вычислить из экспериментальных данных σжг и cosΘ.
Из уравнения 4.1.4. видно, что чем больше адгезия (работа адгезий), тем больше cosΘ, т.е. смачивание.
Силы межфазного взаимодействия (адгезионные силы) стремятся растянуть каплю, а силы когезии стягивают каплю до полусферы, препятствуя растеканию. Условия смачивания можно выразить через работу (на основе уравнения 4.1.4.):
Wa > 0,5 Wc 4.1.5
Для случая полного несмачивания (Θ = 180°, cos Θ = - 1) Wa = 0. Это – нереализуемый случай. Обычно краевые углы не превышают 150°. При Wa = Wc растекание неограниченно, Θ = 0. При неограниченном растекании Wa ≤ Wc.
Wa – Wc называется коэффициентом растекания.
При смачивании водой ионной поверхности (стекло, кристаллические соли) ион-дипольное взаимодействие (Wa) будет больше, чем диполь-дипольное (Wc).
Гидрофильные поверхности – кварц, стекло, оксиды, гидроксиды металлов, окисленные минералы; гидрофобные – твердые углеводороды, их фторированные производные, листья растений, хитиновый покров насекомых, кожа животных.
Избирательное смачивание имеет место при установлении равновесия между поверхностью раздела двух несмешивающихся жидкостей (воды ж1 и углеводорода ж2) и твердой поверхностью. При этом краевой угол принято отсчитывать в сторону более полярной поверхности, имеющей большее поверхностное натяжение (в данном случае – воды).
 4.1.6
4.1.6
Важной количественной характеристикой энергии смачивания, гидрофильности, гидрофобности твердой поверхности служит удельная теплота смачивания – количество энергии, выделяемое при смачивании единицы массы твердого тела. Эта величина равна разности полных поверхностных энергий границы раздела фаз твердое тело – газ и твердое тело – жидкость.
