
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
3. Кинетика коагуляции электролитами
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции υ — это изменение концентрации коллоидных частиц в единицу времени при постоянном объеме системы.
υ= - (dv /dt) ,
где v — концентрация частиц; t — время.
Знак '' -'' стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции α:
α = Zэф /Z,
где Z — общее число столкновений частиц в единицу времени; Zэф — число эффективных столкновений (т. е. столкновений, приводящих к коагуляции) в единицу времени.
Если α = 0, коагуляция не происходит, коллоидный раствор агрегативно устойчив.
Если α = 1, происходит быстрая коагуляция, т. е. каждое столкновение частиц приводит к их слипанию.
Если 0 < а < 1, наблюдается медленная коагуляция, т. е. только некоторые столкновения частиц приводят к их слипанию.
Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары, должен быть преодолен потенциальный барьер коагуляции AUk. Следовательно, коагуляция произойдет только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной для преодоления этого барьера. Для увеличения степени коагуляции необходимо снижать потенциальный барьер. Это может быть достигнуто добавлением к золю электролита-коагулянта.
Зависимость скорости коагуляции от концентрации электролита представлена на рис. 10.1.
На графике видны три участка:
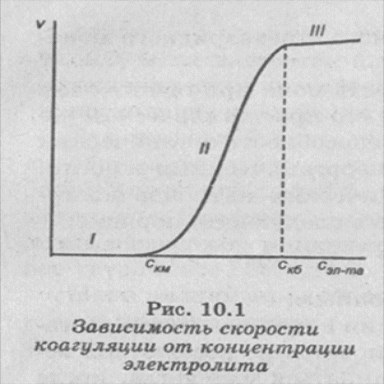
I. υ= - (dv /dt) = 0 , α = 0. Следовательно, кинетическая энергия kT « ΔUk , (k — постоянная Больцмана) — лио-фобный золь агрегативно устойчив.
II. υ= - (dv /dt)>0; 0 < α < 1; кТ <=ΔUK, т. е. потенци альный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита-коагулянта он уменьшается, а скорость коагуляции возрастает. Скм — порог медленной коагуляции, СКб — порог быстрой коагуляции. Этот участок кривой выражает зависимость:
υ = f(c); α = f(c) ; ΔUK = f(с). На этом участке происходит медленная коагуляция.
III. υ= - (dv /dt)>0; υ ≠ f(c) α = 1; kT » ΔUk..
Каждое столкновение приводит к слипанию частиц — идет быстрая коагуляция.
Быстрая коагуляция
Теория быстрой коагуляции, разработанная М. Смолу-ховским в 1916 г., основана на следующих положениях.
1. Рассматриваемая система является монодисперсной, радиус частиц r.
2. Zэф /Z = 1, т. е. все столкновения являются эффек-тивными.
3. Рассматриваются только столкновения первичных частиц.
4. Кинетика коагуляции подобна кинетике бимолекулярной реакции: - (dv /dt) = kv2 ,
где к — константа скорости коагуляции.
Проинтегрируем это уравнение, разделив переменные:

где vo — концентрация частиц золя в начальный момент времени; vt — концентрация частиц золя в момент времени t.
Для характеристики быстрой коагуляции используется период коагуляции (период половинной коагуляции) θ.
Период коагуляции (θ) — это время, через которое концентрация коллоидных частиц уменьшается в два раза.
При vt = vo /2 t = θ
θ = 1/ k vo .
Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть вычислена по уравнению
k = 16πDr.
Если подставить в это уравнение величину коэффициента диффузии (уравнение 9.5), получим:
к = 8RT / 3NA η .
Таким образом, зная вязкость дисперсионной среды и температуру, можно вычислить константу скорости быстрой коагуляции. Теория Смолуховского неоднократно проверялась экспериментально и получила блестящее подтверждение, несмотря на сделанные автором допущения.
