
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
§ 4. Строение мицелл в гидрофобных коллоидных системах.

 4
4
[

 (AgCl)m
nClֿ(n-x)K
]
(AgCl)m
nClֿ(n-x)K
]![]() xK
}мицелла
xK
}мицелла
 1
2 3
1
2 3
ядро; 2- адсорбционный слой; 3- диффузионный слой; 4- гранула.
Гранула имеет тот же заряд, что и весь слой потенциалопределяющих ионов. Заряд на грануле компенсируется зарядом диффузной части ДЭС, поэтому мицелла в целом нейтральна.
§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
Термодинамическим параметром заряженной поверхности служит электрохимический потенциал μ.
μэл = μi + zFφ ,
где μi – химический потенциал данного иона, zFφ – электрический компонент электрохимического потенциала, т.е. работа переноса 1 моль ионов с зарядом zF (Кл/моль) в точку электрического поля с потенциалом φ (В).
Из-за наличия диффузной части электрический потенциал ДЭС (φ) зависит от расстояния (x) от поверхности раздела фаз.
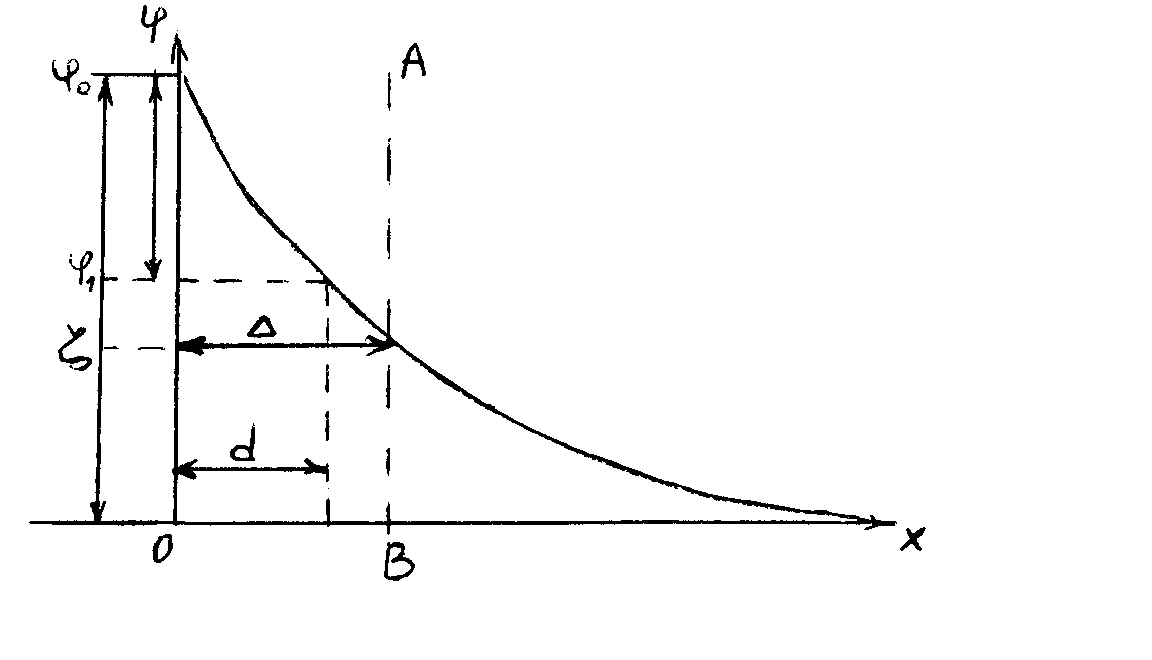
Рис. φ0
– полное падение потенциала, φ0
– φ- падение потенциала в адсорбционном
слое, АВ – плоскость скольжения.![]()
Падение потенциала на АВ называется дзета-потенциалом ζ (электрокинетическим).
Рис.
ζ можно измерить в отличие от всех остальных.
§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
По действию элементы делятся на 2 группы:
1. Индифферентные электролиты – это электролиты, которые не содержат ионы, входящие в состав твердой частицы, или изоморфные ионы (не могут достроить решетку). Ионы этих элементов не влияют на скачок потенциала на границе раздела фаз и на плотность поверхностного заряда. Такие элементы оказывают влияние на эффективную толщину ДЭС. Если в состав элемента входят противоионы, то добавление элемента вызывает сжатие ДЭС и изменение его толщины. При вводе дополнительных ионов одного знака с противоионами значительную роль играет их адсорбционная способность, которая повышается с увеличением размеров и валентности ионов.
При ионной адсорбции выполняется ряд закономерностей:
1) При одинаковом заряде ионов их адсорбционная способность увеличивается по мере увеличения их ионного радиуса. Эта закономерность объясняется тем, что, чем больше размер иона, тем слабее он гидратируется водой.
Гидратная оболочка иона уменьшает его притяжение к противоположному иону на твердой поверхности. По способности к адсорбции катионы одно- и двухвалентных металлов располагаются так (лиотропный ряд):
Li < Na < K < Rb < Cs ;
Mg![]() < Ca
< Sr
< Ba
.
< Ca
< Sr
< Ba
.
Для однозарядных анионов возрастание адсорбции происходит в следующем порядке:
Clֿ < Brֿ < NO3ֿ < Iֿ < NCSֿ .
2) Адсорбционная способность ионов повышается при увеличении их заряда, т.к. при этом увеличивается их электростатическое притяжение к соответствующим ионам на твердой поверхности:
K
<< Ca
<< Al![]() << Th
<< Th![]() .
.
Крупные многовалентные ионы могут вызывать сжатие ДЭС и, кроме того, проникать в слой потенциалопределяющих ионов и применять знак ζ-потенциала. Этот эффект называют перезарядкой. Перезарядка вследствие адсорбции многовалентных ионов ведет к изменению знака электрокинетического потенциала, однако скачок потенциала на границе раздела фаз сохраняет свою величину и знак.
Рис.
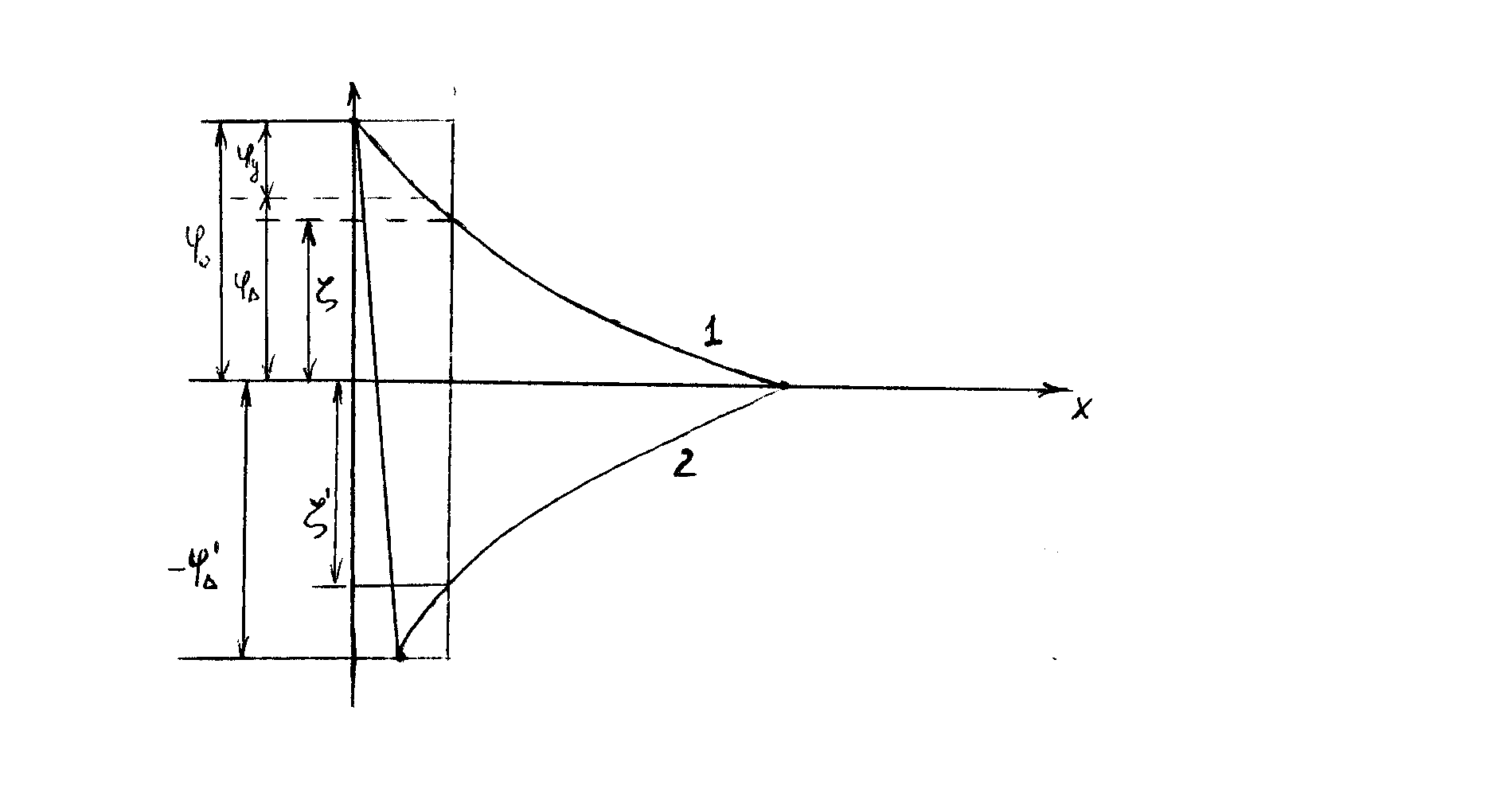
Подпись к рис.:
Изменение потенциала ДЭС в зависимости от расстояния от заряженной поверхности. В исходной системе (кривая 1) и при перезарядке дисперсных частиц в результате адсорбции многовалентных ионов (кривая 2).
2. Неиндифферентные электролиты – электролиты, содержащие ионы, способные достраивать кристаллическую решетку твердой фазы. Здесь возможны 2 варианта:
1) вводимые дополнительно ионы имеют одинаковый знак с потенциалопределяющими ионами. Тогда при небольшой концентрации элемента происходит повышение потенциала φо . Дальнейший рост концентрации приведет к сжатию диффузной части, вплоть до полного отсутствия диффузной части.
2) вводимые дополнительно ионы имеют знак противоионов. Тогда они вначале вызывают сжатие ДЭС, а при достаточно большой концентрации ведут к перезарядке поверхности.
Таким образом, подбирая соответствующие элементы, можно весьма эффективно регулировать электроповерхностные свойства дисперсных частиц.
Лекция 8
МЕТОДЫ ПОЛУЧЕНИЯ И ИССЛЕДОВАНИЯ ДИСПЕРСНЫХ СИСТЕМ
Лекция 9, 10
ОРГАНИЧЕСКАЯ УСТОЙЧИВОСТЬ ДИСПЕРСНЫХ СИСТЕМ
Выше отмечалось, что образование дисперсных систем сопровождается увеличением свободной энергии системы. Следовательно, дисперсная система является принципиально термодинамически неустойчивой, т. е. рано или поздно должна самопроизвольно разрушиться. Поэтому речь может идти только об относительной термодинамической устойчивости дисперсных систем.
Относительная устойчивость — это способность системы в течение определенного времени сохранять неизменной свою структуру, т. е. размеры частиц и их равномерное распределение в объеме системы.
Относительная устойчивость разных дисперсных систем колеблется в достаточно широких пределах. Как мы увидим дальше, эмульсия без эмульгатора разрушается в течение нескольких секунд с момента ее образования, а красный золь золота, полученный Фарадеем в середине XIX в., «живет» до сих пор.
Следовательно, существуют какие-то причины длительного существования принципиально неустойчивых (термодинамически) систем.
Проблема
устойчивости дисперсных систем —
одна
из важнейших проблем коллоидной
![]() химии.
химии.
В 1917 году Песков предложил разграничивать относительную устойчивость дисперсных систем как:
а) седиментационную (кинетическую) устойчивость;
б) агрегативную устойчивость.
Эти два вида устойчивости различны по своему механизму и требуют раздельного рассмотрения.
