
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
§ 2. Электрокапиллярные явления
Поверхностное натяжение, если поверхность заряжена, зависит не только от химической природы граничащих фаз, но и от электрических свойств: плотности поверхностного заряда ( ρs ) [ Кл/м2] и φ – разность потенциалов на границе раздела фаз [В].
Зависимость σ от φ в этом случае называется электрокапиллярной кривой:
σ = f (φ)
А поверхностные явления, обусловленные этой зависимостью. Называются электрокапиллярными.
Значение этих явлений велико, они позволяют регулировать поверхностное натяжение жидкостей и твердых тел, эффективно влиять на коллоидно-химические процессы: смачивание, адгезию, диспергирование.
Рассмотрим зависимость σ = f (φ) на качественном уровне. Термодинамика определяет поверхностное натяжение как работу изотермического процесса образования единицы поверхности:
σ = dW / ∂ S
Если на данной поверхности находятся одноименные электрические заряды, то они будут отталкиваться друг от друга. Силы электростатического отталкивания направлены тангенсально поверхности и стремятся увеличить ее площадь. Таким образом, работа, необходимая для увеличения электрозаряженной поверхности будет меньше, чем для электронейтральной поверхности.
Р ассмотрим
электрокапиллярную кривую ртути в
водных растворах электролитов при
комнатной температуре.
ассмотрим
электрокапиллярную кривую ртути в
водных растворах электролитов при
комнатной температуре.
σ, мДж/м2
450
400
350
300
+0,5
0
-0,5
-1
φ , (В)
ПНЗ






То есть в точке максимума заряд равен 0 Кл. – это ПНЗ (потенциал нулевого заряда).
Максимум σ соответствует электронейтральной поверхности ртути, т. е. ρs = 0, значит потенциал, при котором поверхностное натяжение электрода максимально, называют ПНЗ (φн.з.).
Значение ПНЗ зависит от природы жидкого электролита и состава раствора.
Левую часть электрокапиллярной кривой (φ<ПНЗ) называют анодной ветвью.
Правая часть - (φ>ПНЗ) – катодная ветвь.
Небольшие изменения потенциала (десятые доли В) приводят к существенным изменениям поверхностного натяжения, примерно 10 мДж/м2.
Зависимость поверхностного натяжения от потенциала описывается уравнением Липпмана:
d σ / d φ = ε ε0 φ / r = q / 4 π r2 = ρs
Применение электрокапиллярных явлений: для регулирования смачивания твердых металлов жидкими, - используется при нанесении различных покрытий на металлы.
§ 3. Строение дэс
Рассмотрим
образование двойного электрического
слоя на примере золя AgCl
с отрицательно-заряженной поверхностью.
Золь образуется на поверхности кристаллов
AgCl,
состоящих из ионов Ag![]() и Clֿ.
Возле положительно-заряженных ионов
Ag
адсорбируется слой ионов Clֿ,
на поверхности AgCl
адсорбируются также возле Clֿ
ионы
Ag
(при избытке его в растворе). Тогда
поверхность приобретет положительный
заряд. Достройка ионного кристалла
ионами Ag
или Clֿ
идет
по правилу
Фаянса-Содди.
Согласно нему кристаллическая решетка
достраивается ионами, входящими в состав
кристаллической решетки или близкими
им по свойству. В случае избытка Clֿ
поверхность
кристалла становится отрицательной.
Ионы Clֿ,
адсорбированные на кристалле АgCl,
называются потенциалопределяющими.
Они формируют первый слой ДЭС, находящийся
у твердой поверхности. Потенциалопределяющие
ионы Clֿ
входят
в состав твердой частицы и образуют ее
наружный слой 1.
и Clֿ.
Возле положительно-заряженных ионов
Ag
адсорбируется слой ионов Clֿ,
на поверхности AgCl
адсорбируются также возле Clֿ
ионы
Ag
(при избытке его в растворе). Тогда
поверхность приобретет положительный
заряд. Достройка ионного кристалла
ионами Ag
или Clֿ
идет
по правилу
Фаянса-Содди.
Согласно нему кристаллическая решетка
достраивается ионами, входящими в состав
кристаллической решетки или близкими
им по свойству. В случае избытка Clֿ
поверхность
кристалла становится отрицательной.
Ионы Clֿ,
адсорбированные на кристалле АgCl,
называются потенциалопределяющими.
Они формируют первый слой ДЭС, находящийся
у твердой поверхности. Потенциалопределяющие
ионы Clֿ
входят
в состав твердой частицы и образуют ее
наружный слой 1.
За счет кулоновского взаимодействия они притягивают к себе из раствора электролита (КСl) ионы другого знака – ионы К .
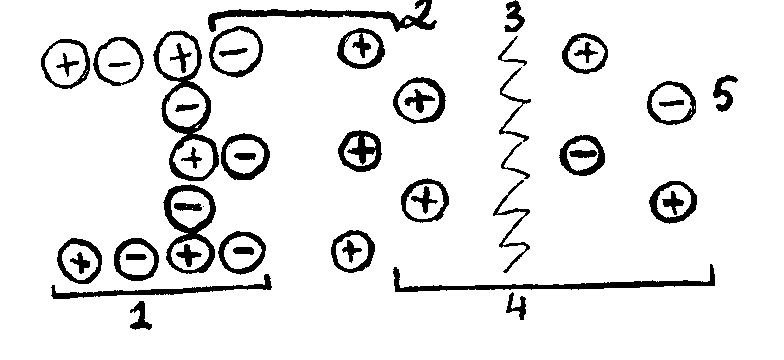
Рис.
1-ядро, 2-плотная часть, 3-плоскость скольжения, 4-слой потенциалопределяющих ионов, 5-диффузная часть.
Эти ионы (К ) называются противоионами. Они находятся в жидкой дисперсионной среде и образуют двойной слой ионов ДЭС. Часть противоионов располагается на расстоянии их диаметра (d) от слоя потенциал определяющих ионов. Эти ионы образуют плотную часть ДЭС (адсорбционный слой). Другая часть противоионов находится на более удаленном расстоянии и образует диффузную часть ДЭС (диффузный слой).
Распределение противоионов определяют два процесса:
а) электростатическое притяжение к потенциалопределяющим ионам;
б) диффузия из области высокой концентрации противоионов вглубь раствора, где концентрация противоиона равна концентрации электролита в растворе.
Наряду с противоионами в диффузной части ДЭС находятся ионы одного знака с потенциалопределяющими ионами, их называют коионами (в нашем случае Clֿ).
Таким образом, распределение ионов в диффузной части ДЭС соответствует динамическому равновесию адсорбционного и десорбционного процесса на поверхности раздела фаз.
ДЭС по составу и строению резко отличается от жидкой фазы. ДЭС представляет собой самоорганизованную упорядоченную структуру. Эта способность самоорганизации имеет очень важное значение для образования и функционирования биологических структур (клеток, мембран и др.).
