
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
§5. Термодинамика молекулярной адсорбции из раствора
Молекулярная адсорбция – адсорбция из растворов неэлектролитов или слабых электролитов. В этих случаях растворенные вещества адсорбируются на поверхности твердого тела в виде молекул.
Особенностью такой адсорбции состоит в том, что наряду с растворенным веществом адсорбируются молекулы растворителя. Активные центры на поверхности твердого тела в той или иной степени заняты молекулами растворителя. Для адсорбции растворенного вещества его молекулы должны вытеснить с поверхности молекулы растворителя.
Факторы, влияющие на молекулярную адсорбцию:
равновесная концентрация растворенного вещества;
природа растворителя;
природа адсорбента;
природа растворенного вещества;
температура, время адсорбции.
При изучении адсорбции пользуются различными кривыми. Экспериментально получают зависимость σ от С2. По этим кривым можно построить кривую Г2 от С2. Кривые Г2–С2 называются изотермами адсорбции (см. рис.1).
Адсорбция с ростом С2 возрастает, приближаясь к пределу. Предельные значения Г∞ называется предельной адсорбцией. Существование этого предельного значения объясняется тем, что тонкий слой при высоких концентрациях ПАВ в растворе насыщается молекулами ПАВ и, когда этот слой полностью насыщен, мы получаем мономолекулярный слой ПАВ на поверхности.
Строение ПАВ можно представить следующим образом:
Они состоят из полярной головки и гидрофобного хвоста, т.е. обладают дифильностью.
«Головкой» она ориентируется к полярной фазе, а хвостом – к неполярной. На границе водный раствор– воздух «головка» будет погружена в раствор , а «хвостом» – к воздуху.
§6. Правило уравнивания полярности Ребиндера.
Процесс адсорбции идет в сторону выравнивания полярности фаз, тем сильнее, чем больше первоначальная разность полярностей.
Если дисперсная фаза–дисперсионная среда резко различаются по полярностям, взаимодействие между ними незначительно, а поверхностная энергия велика, что создает благоприятные условия для адсорбции растворенного вещества, а не растворителя, т.е. чем больше свободная поверхностная энергия, тем больше вероятность снижения ее за счет адсорбции растворенного вещества, обладающего обычно промежуточной полярностью (ПАВ).
Пример 1. Для адсорбирования бензойной кислоты из водного раствора используем активированный уголь.
Пример 2. Для того, чтобы адсорбировать бензойную кислоту из бензола, используем силикагель.
§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
Уравнение получено Ленгмюром для границы раздела твердое тело–газ, однако, оно может быть распространено и на границе жидкость–газ.
В растворе ПАВ наблюдаются две тенденции:
1) Движение молекул ПАВ из объема на поверхность, приводящее к уменьшению поверхностной энергии и концентрированию ПАВ на поверхности.
2) Движение молекул ПАВ с поверхности в объем раствора (для выравнивания градиента концентрации), этот процесс ведет к увеличению энтропии.
Т.о. адсорбционное равновесие на поверхности раствор ПАВ–газ носит динамический характер.
Ленгмюр в 1932 г. был награжден Нобелевской премией по химии.
Модель Ленгмюра процессов адсорбции и десорбции ПАВ:
Молекулы ПАВ могут адсорбироваться из раствора только на свободных от ПАВ участках поверхности раствора.
Поверхностный (адсорбционный) слой ПАВ состоит только из одного слоя молекул ПАВ (монослой), поэтому теорию Ленгмюра называют теорией мономолекулярной адсорбции.
Исходя из этого получается, что удельная адсорбция имеет предельное значение Гmax. Введем понятие–доля поверхности, занятой молекулами ПАВ, θ, где:
![]() =
=
![]() 6.3.1.
6.3.1.
Соответственно доля свободной поверхности, которая будет равна:
1-![]()
(доля свободной поверхности, которая доступна для адсорбции дополнительных молекул ПАВ).
Рассчитаем скорость адсорбции (моль/ м2 с) :
ПАВ + свободная поверхность ↔ поверхность, занятая ПАВ
![]() 6.3.2.
6.3.2.
![]() 6.3.3.
6.3.3.
При равновесии
![]() 6.3.4.
6.3.4.
![]() =[моль/
м2
с]
=[моль/
м2
с]
![]() =[л/
м2
с ]
=[л/
м2
с ]
![]() 6.3.5.
6.3.5.
![]() 6.3.6.
6.3.6.
![]()
![]() 6.3.7.
6.3.7.
![]() 6.3.9.
6.3.9.
![]() 6.3.10.
6.3.10.
![]() 6.3.11.
6.3.11.
![]() 6.3.12.
6.3.12.
Рассмотрим два предельных:
В области малых концентраций, когда выполняется условие АС<<1.
Из уравнения Ленгмюра следует, что удельная адсорбция Г прямо пропорциональна объемной концентрации ПАВ С:
![]() 6.3.13.
6.3.13.
Т.е. начальный участок изотермы адсорбции представляет область Генри для поверхностного раствора ПАВ:
![]() 6.3.14.
6.3.14.
В области больших концентраций, когда
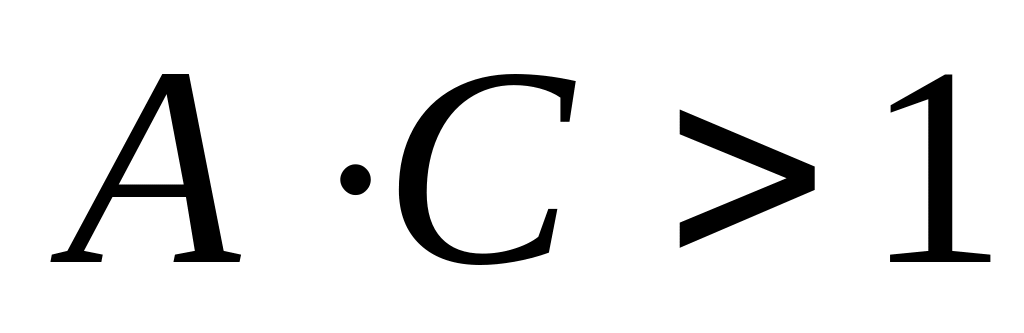 ( пренебрегаем единицей):
( пренебрегаем единицей):
![]() ,
,
т.е. достигается предельная максимальная адсорбция.
Для нахождения
констант (
![]() и
и
![]() )
уравнение 6.3.12. приводят к линейной
форме:
)
уравнение 6.3.12. приводят к линейной
форме:
![]() 6.3.15.
6.3.15.
![]() 6.3.16.
6.3.16.
![]() 6.3.17.
6.3.17.
