
- •Лекция 1 введение. Классификация дисперсных систем
- •§ 1. Предмет коллоидная химия
- •§ 2. Количественные характеристики дисперсных систем
- •§ 3. Классификация дисперсных систем
- •1. Классификация по дисперсности (по размеру частиц):
- •2. Классификация по фракционному составу частиц дисперсной фазы.
- •3. Классификация по концентрации частиц дисперсной фазы.
- •4. По характеру взаимодействия дисперсионной фазы с дисперсионной средой.
- •5. По характеру распределения фаз.
- •§4. История развития коллоидной химии
- •§5. Современное состояние коллоидной химии. Основные направления
- •Лекция 2 Молекулярные взаимодействия и особые свойства поверхностей раздела фаз
- •§ 1. Граница раздела фаз и её силовое поле
- •§2. Поверхностное натяжение
- •§3. Основы термодинамики поверхностных явлений
- •§ 4. Смачивание
- •§ 5. Капиллярность. Капиллярное давление
- •§ 6. Изменение уровня жидкостей в капиллярах.
- •§ 7. Химический потенциал и давление пара у искривленных поверхностей.
- •§ 8. Методы определения поверхностного натяжения
- •Лекция 3, 4 Адсорбционные слои и их влияние на свойства дисперсных систем. Термодинамика молекулярной адсорбции из раствора
- •§ 1. Введение
- •§2. Уравнение адсорбции Гиббса.
- •§3. Поверхностная активность.
- •§ 4. Поверхностно-активные вещества
- •2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
- •3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
- •§5. Термодинамика молекулярной адсорбции из раствора
- •§6. Правило уравнивания полярности Ребиндера.
- •§7. Уравнение изотермы мономолекулярной адсорбции Ленгмюра.
- •§8. Связь уравнения Ленгмюра с уравнением изотермы Шишковского.
- •Лекция 5 лиофильные дисперсные системы
- •§1. Лиофильные дисперсные системы
- •§2. Солюбилизация
- •§ 3. Микроэмульсии
- •§ 1. Электрокинетические явления в коллоидных системах
- •§ 2. Электрокапиллярные явления
- •§ 3. Строение дэс
- •§ 4. Строение мицелл в гидрофобных коллоидных системах.
- •§ 5. Электрический потенциал в дэс. Электрокинетический потенциал.
- •§ 6. Влияние индифферентных и неиндифферентных электролитов на электрокинетический потенциал и заряд коллоидных частиц. Перезарядка частиц.
- •1. Седиментационная устойчивость дисперсных систем
- •2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •Правила коагуляции
- •3. Кинетика коагуляции электролитами
- •Быстрая коагуляция
- •Медленная коагуляция
- •Факторы устойчивости лиофобных золей
- •Теория устойчивости лиофобных золей — теория длфо (физическая теория)
- •4. Виды коагуляции электролитами
- •5. Коагуляция смесью электролитов
- •6. Защита коллоидных частиц
- •7. Сенсибилизация
- •8. Гетерокоагуляция и гетероадагуляция
- •9. Устойчивость различных систем
- •Лекция 11, 12 Структурообразование, реологические и структурно-механические свойства дисперсных систем
- •1. Коагуляционные структуры
- •Тиксотропия
- •Синерезис
- •Набухание
- •2. Конденсационно-кристаллизационные структуры
- •3. Структурно-механические свойства дисперсных систем
- •Свободнодисперсные (бесструктурные) системы
- •Жидкообразные структурированные системы
- •Твердообразные структурированные системы
2). Разнообразные по природе вещества, поверхностно-активные на различных границах раздела конденсированных фаз (твердое тело—жидкость, жидкость — жидкость).
ПАВ этой группы в условиях сильного понижения поверхосиного натяжения на межфазной границе содействуют развитию новых поверхностей раздела фаз в процессах разрушения, диспергирования и обработки твердых тел и эмульгирования жидкостей. Такие ПАВ можно объединить по их действию общим названием диспергаторы. Вещества, относящиеся к этой группе ПАВ, позволяют также управлять избирательным смачиванием .
Для обеих этих групп характерно отсутствие у молекул ПАВ способности образовывать пространственные гелеподобные структуры как в объеме фаз, так и на поверхности их раздела.
3).Поверхностно-активные вещества, обладающие способностью к образованию гелеподобных структур, т. Е. В известной мере твердообразных, в адсорбционных слоях и в объемах фаз.
При этом в некоторых случаях относящиеся сюда ПАВ могут и не иметь высокой поверхностной активности. Большинство ПАВ, принадлежащих к этой группе,—высокомолекулярные, природные или синтетические вещества преимущественно сложного строения, с большим числом полярных групп (белки, глюкозиды, производные целлюлозы, поливиниловый спирт и т. п.). Такие вещества используют как высокоэффективные стабилизаторы умеренно концентрированных дисперсных систем различной природы: пен, эмульсий, суспензий. ПАВ этой группы могут выступать как пластификаторы высококонцентрированных дисперсий (паст).
4). Поверхностно-активные вещества, обладающие моющим действием.
Они объединяют функции всех трех предыдущих групп ПАВ и, кроме того, способны к самопроизвольному образованию в объеме жидкой фазы термодинамически стабильных коллоидных частиц (мицеллообразование в растворах ПАВ) и к включению отмываемых частиц в ядро мицелл (солюбилизация). Сюда входят различные анионные, катионные и неионогенные ПАВ.
По химическому строению ПАВ могут быть разделены на два больших класса. Это, с одной стороны, органические ПАВ с дифильными молекулами, универсально поверхностно-активные на большинстве межфазных границ (естественно, ниже температуры их разложения), но обеспечивающие обычно лишь относительно небольшое понижение поверхностного натяжения (на 30—40 мДж/м2). С другой стороны, это самые разнообразные, прежде всего неорганические вещества, проявляющие избирательную, но часто очень высокую поверхностную активность по отношению к данной конкретной границе раздела, способные вызывать здесь весьма резкое понижение поверхностного натяжения (легкоплавкие металлы по отношению к определенным более тугоплавким, вода по отношению к ряду солей и т. д.).
Рассмотрим так же классификацию, принятую на III Международном конгрессе по ПАВ и рекомендованная Международной организацией по стандартизации (ISO)в 1960. Она основана на химической природе молекул и включает четыре основных класса ПАВ: анионактивные, катионактивные, неионогенные и амфотерные. Иногда выделяют также высокомолекулярные (полимерные), перфторированные и кремнийорганические ПАВ, однако по хим. природе молекул эти ПАВ могут быть отнесены к одному из вышеперечисленных классов.
Анионактивные ПАВ содержат в молекуле одну или несколько полярных групп и диссоциируют в водном р-ре с образованием длинноцепочечных анионов, определяющих их поверхностную активность. Это группы: COOH(M), OSO2OH(M), SO3H(M), где M-металл (одно-, двух- или трехвалентный). Гидрофобная часть молекулы обычно представлена предельными или непредельными алифатическими цепями или алкилароматическими радикалами. Выделяют 6 групп анионактивных ПАВ.
1) Производные карбоновых кислотт (мыла): RCOOM, ROOC (СН2)nСООМ, RC6H4 (СН2)nСООМ, RCH=CH — —(СН2)nСООМ.
2) Первичные и вторичные алкилсульфаты ROSO3M, R'R:CHOSO3M, алкиларилэтилсульфаты RC6H4C2H4OSO3M, алкилциклогексилэтилсульфаты RC6H10C2H4OSO3M и т.п.
3)Алкил- и алкилбензолсульфонаты, сульфонаты сложных эфиров моно- и дикарбоновых к-т: RSO3M, RC6H4SO3M, ROOCCH2SO3M, ROOCCH2CH(COOR)SO3M .
4) Сульфо- и карбокси-этоксилаты спиртов, сульфоэтоксилаты карбоновых к-т, сульфоэтоксилаты алкилфенилэтиловых спиртов, соли сульфатов непредельных к-т: RO(C2H4O)nSO3M, RO(C2H4O)nCH2COOM, RCOO (C2H4O)n SO3M, RC6H4 (C2H4O)2 SO3M, ROOCCH2CH ·(COOM) SO3M, RCH (OSO3M)=CH (CH2)n—COOM.
5) Азотсодержащие ПАВ: амидосульфонаты RCONR'—R:—SO3M, амиды сульфокарбоновых к-т RR'NOC—R:—SO3M, амидосульфаты RCONR'- R:—OSO3M, амидокарбоксилаты RCO(NH-R'—CO)nOM, в-ва с карбокси- и сульфогруппами RCONH—R—OCOR:(SO3M) —COOM. Вместо амидной группы во многих таких в-вах могут быть также сульфоамидная группа, например RC6H4SO2NHCH2CH2SO3M.
6) Соли перфторирированных карбоновых кислот, перфторированных сульфоацетатов, моно- и диалкил-фосфатов и фосфонатов, перфторир. фосфонаты и др. соединения.
В анионактивных ПАВ катион может быть не только металлом, но и органическим основанием. Часто это ди- или триэтаноламин. Поверхностная активность начинает проявляться при длине углеводородной гидрофобной цепи C8 и с увеличением длины цепи увеличивается вплоть до полной потери растворимости ПАВ в воде. В зависимости от структуры промежуточных функциональных групп и гидрофильности полярной части молекулы длина углеводородной части может доходить до C18. Бензольное ядро соответствует примерно 4 атомам С, перфто-рированная метиленовая группа CF2-примерно 2,5-3 метиленовым группам.
Наиболее распространены алкилсульфаты и алкиларилсульфонаты. Оптимальными поверхностно-активными свойствами обладают первичный додецилсульфат и прямоцепочечный додецилбензолсульфонат. Эти веществав термически стабильны, малотоксичны (ЛД50 1,5-2 г/кг, белые мыши), не раздражают кожу человека и удовлетворительно подвергаются биологическому распаду в водоемах , за исключением алкиларил-сульфонатов с разветвленной алкильной цепью. Они хорошо совмещаются с др. ПАВ, проявляя при этом синергизм, порошки их негигроскопичны. Вторичные алкилсульфаты обладают хорошей пенообразующей способностью, но термически неустойчивы и применяются в жидком виде. Вторичные алкилсульфонаты обладают высокой поверхностной активностью, но весьма гигроскопичны. Перспективными являются ПАВ, у которых гидрофильная часть состоит из нескольких функциональных групп. Например динатриевые соли сульфоянтарной к-ты обладают хорошими санитарно-гигиеническими свойствами наряду с высокими коллоидно-химическими и технологическими показателями при растворении в жесткой воде. ПАВ, содержащие сульфониламидную группу, обладают биол. активностью. Хорошими свойствами обладает также додецил-фосфат.
Катионактивными называются ПАВ, молекулы которых диссоциируют в водном р-ре с образованием поверхностно-активного катиона с длинной гидрофобной цепью и аниона-обычно галогенида, иногда аниона серной или фосфорной к-ты. Преобладающими среди катионактивных ПАВ являются азотсодержащие соед.; практич. применение находят и в-ва, не содержащие азот: соед. сульфония [RR'R:S]+X- и сульфоксония [RR'R:SO]+Х-, фосфония [R3PR']+ X-, арсония [R3AsR'] + Х-, иодония (ф-ла I). Азотсодержащие соед. можно разделить на след. осн. группы: 1) амины и их соли RNR'R: · HX;
2) моно- и бисчетвертичные аммониевые соед. алифатич. структуры [RNR'R:R''']+ X-, [RR'2N-R:—NR'2R]2+2Х-, соед. со смешанной алифатической и ароматической структурой [RR'2 NC6H4NR'2 R]2 + 2Х- ;
3) четвертичные аммониевые соединения с различными функциональными группами в гидрофобной цепи;
4) моно- и бисчетвертичные аммониевые соед. с атомом азота в гетероциклическом кольце. Последняя группа объединяет сотни ПАВ, имеющих промышленное значение. Важнейшие из них-соединения пиридина, хинолина, фталазина, бензимидазола, бензотиазола, бензотриазола, производные пирролидина, имидазола, пиперидина, морфолина, пиперазина,
бензоксазина и др.;
5) оксиды аминов RR'R:N+O- (начато промышленное производство);
6) полимерные ПАВ (II). Применяют в основном поливинилпиридинийгалогениды.
Катионактивные ПАВ меньше снижают поверхностное натяжение, чем анионактивные, но они могут взаимодействовать химически с поверхностью адсорбента, например с клеточными белками бактерий, обусловливая бактерицидное действие. Взаимод. полярных групп катионактивных ПАВ с гидроксильными группами волокон целлюлозы приводит к гидрофобизации волокон и импрегнированию тканей.
Неионогенные ПАВ не диссоциируют в воде на ионы. Их р-римость обусловлена наличием в молекулах гидрофильных эфирных и гидроксильных групп, чаще всего полиэтиленгликолевой цепи. По-видимому, при растворении образуются гидраты вследствие образования водородной связи между кислородными атомами полиэтиленгликолевого остатка и молекулами воды. Вследствие разрыва водородной связи при повышении температуры растворимость неионогенных ПАВ уменьшается, поэтому для них точка помутнения -верхний температурный предел мицеллообразования- является важным показателем.. Характерная особенность неионогенных ПАВ-жидкое состояние и малое пенообразование в водных р-рах.
Неионогенные ПАВ разделяют на группы, различающиеся строением гидрофобной части молекулы, в зависимости от того, какие в-ва послужили основой получения полигликолевых эфиров. На основе спиртов получают оксиэтилированные спирты RO(C2H4O)nH; на основе карбоновых к-т - оксиэтилированные жирные кислоты RCOO (C2H4O)n H; на основе алкилфенолов и алкилнафтолов - оксиэтилированные алкилфенолы RC6H4O(C2H4O)nH и соединения RC10H6O-— (C2H4O)nH и т.д.
Коллоидно-химические св-ва ПАВ этого класса изменяются в широких пределах в зависимости от длины гидрофильной полигликолевой цепи и длины цепи гидрофобной части таким образом, что различные представители одного гомологического ряда могут быть хорошими смачивателями и эмульгаторами. Поверхностное натяжение гомологов оксиэтилированных алкилфенолов и первичных спиртов при постоянном содержании этиленоксидных групп уменьшается в соответствии с правилом Траубе, т. е. с каждой дополнит. группой CH2 поверхностное натяжение снижается. Смачивающая способность неионогенных ПАВ зависит от структуры; оптимальной смачивающей способностью обладает ПАВ разветвленного строения:
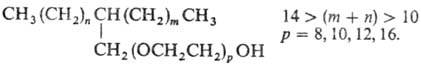
Неионогенные ПАВ хорошо совмещаются с др. ПАВ и часто включаются в рецептуры моющих средств.
Амфотерные (амфолитные) ПАВ содержат в молекуле гидрофильный радикал и гидрофобную часть, способную быть акцептором или донором протона в зависимости от рН р-ра. Обычно эти ПАВ включают одну или несколько основных и кислотных групп, могут содержать также и неионогенную полигликолевую группу. В зависимости от величины рН они проявляют св-ва катионактивных или анионактивных ПАВ. При некоторых значениях рН, называемых изоэлектрической точкой, ПАВ существуют в виде цвиттер-ионов. Константы ионизации кислотных и основных групп истинно растворимых амфотерных ПАВ весьма низки, однако чаще всего встречаются катионно-ориентированные и анионно-ориентированные цвиттер-ионы. В качестве катионной группы обычно служит первичная, вторичная или третичная аммониевая группа, остаток пиридина или имидазолина. В принципе вместо N м. б. атомы S, P, As и т. п. Анионными группами являются карбоксильные, сульфонатные, сульфоэфирные или фосфатные группы.
К природным ПАВ относятся разнообразные биологически активные вещества, среди которых особенно важное значение для жизнедеятельности организмов имеют липиды и белки, а также холевые кислоты, входящие в состав желчи.
Липиды — это сложные эфиры глицерина или сфингозина (длинноцепочечного аминоспирта) и жирных кислот (предельных и непредельных), содержащих в основном углеводородные радикалы С12—С18. Большинство липидов имеют в молекуле две такие гидрофобные цепи. Полярные части могут включать различные химические группы: эфирные (моно-, ди- и триглицери-ды), остатки фосфорной кислоты (фосфолипиды), а также углеводные остатки (в большой группе гликолипидов). В организме липиды, как правило, вместе с белками являются основной составляющей таких биоструктур, как клеточные мембраны.
Поверхностная активность белков, как и многие их функции, зависит от так называемой третичной структуры белковых молекул, которая обусловливается пространственной укладкой их полипептидных цепей. Эта третичная структура молекулы, в свою очередь, зависит от первичной структуры—последовательности аминокислот в молекуле, которая определяется генетическим аппаратом клетки. Поверхность белковой глобулы имеет мозаичный характер—содержит полярные и неполярные участки; при этом доля тех и других примерно одинакова, что характерно для всех белков, в том числе и мембранных. На границе раздела фаз белок обычно адсорбируется в глобулярной форме, причем в ряде случаев могут иметь место изменения конформации макромолекул в адсорбционном слое. Адсорбция белковых молекул в значительной степени необратима, что затрудняет ее описание с помощью уравнения Гиббса.
Возрастает интерес к альтернативным природным ПАВ, синтез которых осуществляется рядом бактерий. Обнаруженные биологические ПАВ бактериального происхождения не уступали по главным техническим показателям химическим аналогам и имели ряд преимуществ: бактерии-продуценты ПАВ не были токсичны и аллергены для человека, животных, птиц, рыб и растений; разлагались в окружающей среде и могли быть использованы в широком интервале температур, солености и рН. К преимуществам биоПАВ относится относительная дешевизна производства - использование для культивирования бактерий простых сред, отсутствие необходимости очистки ПАВ. БиоПАВы могут быть в различных формах, в зависимости от сферы приложения - культуральная жидкость, содержащая ПАВ; паста или гель, сухой порошок. В настоящее время в мире выделен и запатентован ряд бактериальных ПАВ, которые синтезируются штаммами Bacillus subtilis (сурфактанты), Bac. licheniformis (лихензины), Pseudomonas fluorescens (вискозины), Acinetobacter calcoaceticus (эмульсаны) и др.. Перспективность решаемой проблемы обеспечена бактериальной продукцией высокоактивных и стабильных ПАВ на дешевых средах. Так как продукты жизнедеятельности бактерий-продуцентов ПАВ не являются чужеродными для почвы и не токсичны для растительного и животного мира, появляется высокая потенциальная возможность замены химических поверностно- активных веществ биологическими.
Поверхностно-инактивные вещества
Поверхностно-инактивные вещества стремятся уйти с поверхности жидкости в объем, в результате чего происходит отрицательная адсорбция, т.е. Г< 0. Поверхностно- инактивные вещества обладают поверхностным натяжением, большим поверхностного натяжения растворителя( иначе они самопроизвольно накапливались в поверхностном слое), и обычно высокой растворимостью, что способствует их стремлению уйти с поверхности в объем. Другими словами, взаимодействие между молекулами поверхностно-инактивных веществ и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому поверхностно- инактивные вещества стремятся перейти в объем раствора.
Поверхностно- инактивными веществами в отношении воды являются все неорганические электролиты- кислоты, щелочи, соли. Молекулы этих веществ не имеют гидрофобной части и распадаются в воде на хорошо гидратирующиеся ионы. Одновалентные ионы вызывают сравнительно небольшое повышение поверхностного натяжения. Двухвалентные ионы эффективнее одновалентных в эквимолярных растворах.
Применение ПАВ.
Мировое производство ПАВ составляет 2-3 кг на душу населения в год. Примерно 50% производимых ПАВ используется для бытовой химии (моющие и чистящие ср-ва, косметика), остальное в промышленноси и с/хозяйстве. Одновременно с ежегодным ростом производства ПАВ соотношение между их применением в быту и промышленности изменяется в пользу промышленности.
Применение ПАВ определяется их поверхностной активностью, структурой адсорбционных слоев и объемными свойствами р-ров. ПАВ обеих групп (истинно растворимые и коллоидные) используют в качестве диспергаторов при измельчении твердых тел, бурении твердых пород (понизители твердости), для улучшения смазочного действия, понижения трения и износа, интенсивности нефтеотдачи пластов и т. д. Дугой важный аспект использования ПАВ - формирование и разрушение пен, эмульсий, микроэмульсий. Широкое применение ПАВ находят для регулирования структурообразования и устойчивости дисперсных систем с жидкой дисперсионной средой (водной и органической). Широко используются мицеллярные системы, образуемые ПАВ как в водной, так и в неводной среде, для которых важны не поверхностная активность ПАВ и не свойства их адсорбционных слоев, а объемные свойства: резко выраженные аномалии вязкости с повышением концентрации ПАВ вплоть до образования, наприпер в водной среде, кристаллизация структур твердого мыла или твердо-образных структур (в пластичных смазках на основе нефтяных масел).
ПАВ находят применение более чем в 100 отраслях народного хозяйства. Большая часть производимых ПАВ используется в составе моющих средств, в производстве тканей и изделий на основе синтетических и природных волокон. К крупным потребителям ПАВ относятся нефтяная, хим. промышленности, промышленность строителных материалов и ряд других.
