
- •Методы количественного определения неорганических лекарственных препаратов Занятие 13, 14 кислотно-основное и окислительно-восстановительное титрование
- •§1. Введение
- •§2. Теоретические основы титриметрического метода анализа
- •§3. Кислотно-основное титрование
- •§4. Кривые титрования. Выбор индикатора
- •0 4 8 12 16 20 Объем NaOh, мл
- •§5 Лабораторная работа
- •§6. Теоретические основы методов оксидиметрии
- •§7. Типы окислительно-восстановительных реакций
- •§8. Перманганатометрия
- •§9. Иодометрия
- •§10. Лабораторный практикум
- •§11. Задачи для самостоятельного решения
§6. Теоретические основы методов оксидиметрии
Окислительно-восстановительные методы объемного анализа основаны на применении окислительно-восстановительных реакций.
Окислительно-восстановительными реакциями называются такие процессы, в которых происходит переход электронов от одних молекул, атомов, ионов (восстановителей) к другим (окислителям). В результате изменяются степени окисления атомов, входящих в состав реагирующих веществ:
![]()
Окисление – это процесс отдачи электронов атомом, молекулой, ионом; степень окисления при этом повышается:
![]()
![]()
![]()
Восстановление – это процесс присоединения электронов атомом, молекулой, ионом; степень окисления при этом понижается:
![]()
![]()
![]()
Окисление всегда сопровождается восстановлением и наоборот.
![]()
§7. Типы окислительно-восстановительных реакций
1. Реакции межмолекулярного окисления – восстановления – это реакции, в процессе которых обмен электронами происходит между разными молекулами:

2. Реакции диспропорционирования – это такие реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель вследствие того, что содержавшиеся в них атомы с промежуточной степенью окисления отдают и принимают электроны, переходя один – в состояние с низкой степенью окисления, другой – с высокой степенью окисления:

3. Реакции контродиспропорционирования - это реакции, обратные диспропорционированию:
![]()
4. Реакции внутримолекулярного окисления – восстановления – это реакции, в которых окислитель и восстановитель находятся в одной и той же молекуле:

Рабочими растворами в оксидиметрии являются растворы окислителей (KMnO4, К2Сr2O7, I2, KBrO3 и др.) и восстановителей (Na2S2O3, NaAsO2, SnCl2).
Эквиваленты окислителей и восстановителей в оксидиметрии определяют делением молекулярной массы соответствующего вещества на число электронов, которые оно принимает или отдает в рассматриваемой реакции.
Например:

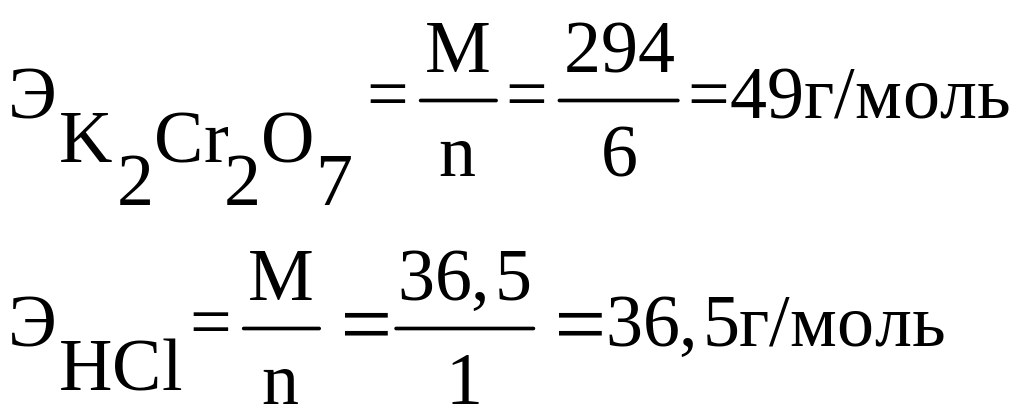
Количественной характеристикой интенсивности окислительно-восстановительного процесса является разность окислительно-восстановительных потенциалов (выражается в вольтах) реагирующих между собой систем.
Окислительно-восстановительный потенциал системы, измеренный при условии, активности ионов восстановленной и окисленной форм равны единице, называют нормальным окислительно-восстановительным потенциалом системы. Зависимость окислительно-восстановительного потенциала системы от концентрации ионов восстановленной и окисленной форм выражают уравнением Нернста:

где [Ox] и [Red] – концентрации восстановленной и окисленной форм системы; n – число принимаемых или отдаваемых электронов при превращении окисленной формы в восстановленную.
Если концентрации [Ox] = [Red], то E = E0, т.е. окислительно-восстановительный потенциал системы будет равен ее нормальному потенциалу.
Все методы оксидиметрии классифицируются в зависимости от окислителя или восстановителя, применяемых в рабочем растворе.
Метод, основанный на окислении перманганатом калия, называют перманганатометрией, на окислении бихроматом калия – хроматометрией и т.д.
В оксидиметрии применяются различные методы определения точки эквивалентности:
исчезновение или появление окраски титранта или титруемого вещества. Например, при титровании раствором KMnO4 с концентрацией не менее 0,02М раствор окрашивается в розовый цвет при введении минимального избытка рабочего раствора (титранта);
окислительно-восстановительные и специфические индикаторы. Специфические индикаторы – это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительно-восстановительной системы. Например, при титровании йода используют специфический индикатор – крахмал, образующий темно-синее окрашивание с ионами йода. Окислительно-восстановительные индикаторы – это соединения, в основном органические, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску (дифениламин и его производные);
физико-химические методы (потенциометрия)
