
- •Рецензент –
- •Введение
- •Введение
- •Раздел 1. Основы химической термодинамики
- •1. 1. Первый закон термодинамики
- •Для конечного изменения состояния системы уравнение (1) можно записать:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •2. Термохимия
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3. Второй закон термодинамики
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Растворы
- •1. Давление пара разбавленных растворов. Закон Рауля.
- •Замерзание и кипение растворов.
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 3. Химическая кинетика
- •Закон действия масс. Кинетическая классификация химических реакций.
- •2. Влияние температуры на скорость химических реакций
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 4. Фазовые равновесия в гетерогенных системах
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Систем различного типа
- •Библиографический список рекомендуемой литературы Основная
- •Дополнительная
- •Основные вопросы для подготовки к экзамену
- •Термодинамические величины некоторых простых веществ и соединений
- •Варианты контрольных заданий
Раздел 4. Фазовые равновесия в гетерогенных системах
Диаграмма состояния двухкомпонентных систем сводится к двухмерному графику, где по оси абциссе откладывают концентрацию одного из компонентов, по оси координат – температуру фазовых превращений. Примером такой диаграммы является диаграмма состояния двухкомпоентной системы, компоненты которой образуют простую эвтектику (рис. 1).
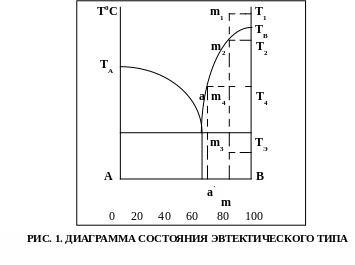
Анализируя диаграмму возможно определить природу и количество образующихся в системе фаз, области их существования и особенности взаимодействия.
Решение типовых задач
Задача 1. Определите качественный и количественный состав системы, обозначенной на рис. 1 точкой m4.
Решение. Данная фигуративная точка находится в области ограниченной линиями ТВ э (линия ликвидус – геометрическое место точек, отвечающих температурам начала кристаллизации расплава и ТЭ э ( линия солидус – линия, отвечающая температурам конца кристаллизации).
Качественный состав любой области диаграммы определяется линиями, ограничивающими эту область. Система, обозначенная на диаграмме т. m4 будет состоять из двух фаз – расплава (на это указывает линия ликвидус ТВэ) и твердый фазы, предоставленной кристаллами компонента В (указывает линия солидус эТЭ и ось состава В).
Количественный состав системы в т. m4 можно определить, если провести горизонтальную линию – конноду до пересчения с линиями, ограничивающими рассматриваемую область Т4а и проходящуючерез т. m4. Точки пересечения конноды укаывают составы двух равновесных при данной температуре фаз. Точка а определяет соста расплава (проектируем ее ось состава а') и отвечает 100% расплава; в точке Т4 – 100% твердой фазы. Для того чтобы определть количество твердой фазы и расплава, весь отрезок (а) принимаем за 100%, точка m4 делит его наотрезок m4а и m4Т4. Согласно правилу рычага отрезки обратно пропорциональны массам фаз, на которые распадается равновесная система:
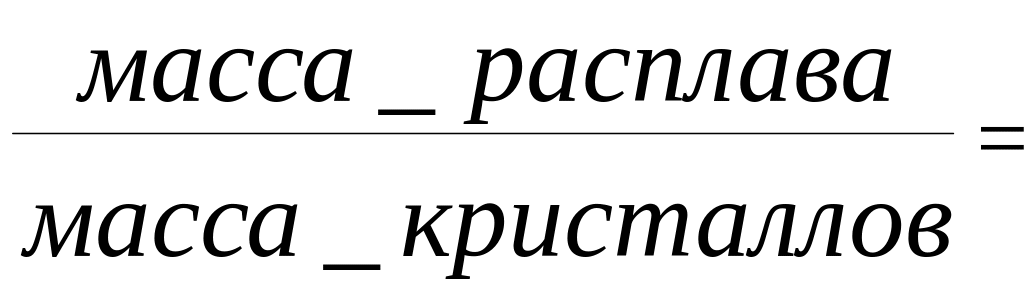 m4Т4
/ а m4.
m4Т4
/ а m4.
Таким образом, отрезок, прилегающий к линии ликвидус, определяет количество твердой фазы, а отрезок, прилегающий к линии 100% В, определяет количество жидкой фазы.
Задача 2. Рассмотрите фазовые превращения, происходящие при охлаждении расплава данной исходной смеси состоящий из 20% компонента А и 80% - В.
Решение. Для того чтобы рассмотреть фазовые изменения при охлаждении расплава данной исходной смеси, нужно из фигуративной точки, отвечающей исходному составу, восстановить перпендикуляр так, чтобы попасть в область расплава. Затем необходимо описать процессы, происходящие при температурах, отвечающих точкам пересечения перпендикуляра с линиями диаграммы, т. е. рассмотреть процессы, происходящие при охлаждении данного расплава.
Рассмотрим последовательность фазовых изменений при охлаждении исходной смеси, состоящей из 20% компонента А и 80% компонента В, нагретой до температуры Т1 (фигуративная точка m1 на рис. 1)
При температуре, отвечающей точке m1, исходная смесь состава m представляет собой расплав. При охлаждении расплава до температуры Т2 ( точка m2 ) из него выпадают первые кристаллы компонента В, при дальнейшем охлаждении количество выпавших кристаллов В будет увеличиваться. При достижении температуры ТЭ из расплава одновременно кристализуются компоненты А и В.
Процесс одновременной кристаллизации двух компонентов называется эвтектическим, а температура при которой это происходит называется температурой эвтектики.
Ниже температуры эвтектики система будет представлять собой твердую фазу, состоящую из крупных, ранее выпавших, кристаллов В и мелких кристаллов эвтектики ( мелкокристаллическая смесь А и В).
