
- •Курсовая работа получение нанокомпозитов на основе бактериальной целлюлозы и изучение их свойств
- •Задание на курсовую работу
- •1 Тема Получение нанокомпозитов на основе бактериальной целлюлозы и изучение их свойств
- •Реферат
- •Содержание
- •1 Аналитический обзор 9
- •2 Материалы и методы исследования 28
- •3 Результаты и их обсуждение 34
- •Обозначения и сокращения
- •Введение
- •1 Аналитический обзор
- •1.1 Строение и свойства бактериальной целлюлозы
- •1.2 Продуценты бактериальной целлюлозы
- •1.3 Применение бактериальной целлюлозы
- •1.4 Композиционные материалы на основе бактериальной целлюлозы
- •2 Материалы и методы исследования
- •2.1 Объект исследования
- •2.2 Методы исследования
- •2.2.1 Условия культивирования уксуснокислых бактерий
- •2.2.2 Выделение бактериальной целлюлозы
- •2.2.3 Определение pH
- •2.2.4 Приготовление микроскопических препаратов
- •2.2.9 Адсорбция антибиотиков на поверхность бактериальной целлюлозы
- •2.2.10 Десорбция антибиотика из бактериальной целлюлозы
- •2.2.11 Определение антибиотической активности полученных нанокомпозитов
- •2.2.12 Статистическая обработка данных
- •3 Результаты и их обсуждение
- •3.1 Исследование гель – пленки бактериальной целлюлозы
- •3.2 Изучение нанокомпозитов на основе гпбц
- •3.3 Исследование антибиотической активности нанокомпозита на основе бактериальной целлюлозы
- •Список использованных источников
2 Материалы и методы исследования
2.1 Объект исследования
В качестве объекта исследования использовали уксуснокислые бактерии – продуценты гель – пленки бактериальной целлюлозы и нанокомпозиты, полученные на основе БЦ.
2.2 Методы исследования
2.2.1 Условия культивирования уксуснокислых бактерий
Для культивирования уксуснокислых бактерий использовали мелассную среду следующего состава, г/л:
1. Свекловичная меласса - 70;
2. Пептон - 20;
3. Дрожжевой экстракт - 10;
4. Этанол - 7;
5. Дистиллированная вода - 1л.
Режим стерилизации среды 120°С в течении 20 минут при 1 атм. Культивирование проводили в колбах на 250 мл, содержащих 60 мл среды, на качалках Unvironmental Shaker - Incubator FS - 20/60 при 250 об/мин в течение 5 суток при температуре 30°С и в стационарных условиях при температуре 30°С в течение 5 суток.
2.2.2 Выделение бактериальной целлюлозы
БЦ, полученную при культивировании уксуснокислых бактерий, обрабатывали 0,1 н раствором NaOH при 80°С в течении 30 минут для удаления клеток и компонентов бактериальной среды. От раствора щелочи бактериальную целлюлозу отмывали дистиллированной водой, 0,5% водным раствором уксусной кислоты и снова водой до нейтральной реакции. Обработку повторяли 3 раза, затем раствор центрифугировали 20 минут при 3000 об/мин. Далее целлюлозу высушивали при 80°С до постоянной массы [21].
2.2.3 Определение pH
Определение рН проводили потенциометрическим методом с помощью прибора «рН meter HI 8014» .
2.2.4 Приготовление микроскопических препаратов
Для изучения микроморфологии культур готовили фиксированные микроскопические препараты бактерий. Окрашивали их по Граму и красителем метиленовым синим.
При окраске бактерий по Граму на предварительно обезжиренных и высушенных предметных стеклах делали мазки. Препараты высушивали на воздухе. Фиксировали над пламенем горелки и окрашивали в течение 1 - 2 минут кристаллическим фиолетовым. Краситель сливали, не промывая препарат водой, обрабатывали его 1 - 2 минуты раствором Люголя до почернения. Сливали раствор Люголя, препарат обесцвечивали 96%-ным раствором этилового спирта. Через полминуты смывали спирт водой и дополнительно окрашивали в течение 1 - 2 минут водным фуксином. Краситель смывали водой, препарат высушивали на воздухе.
При окраске бактерий красителем метиленовым синим на предварительно обезжиренных и высушенных предметных стеклах делали мазки. Препараты высушивали на воздухе, фиксировали над пламенем горелки и окрашивали в течение 1 - 2 минут метиленовым синим. Краситель смывали водой, препараты высушивали на воздухе [50].
Микроскопирование и фотографирование препаратов осуществляли с помощью видеомикроскопа Micros (Австрия) при увеличении в 1000 раз.
2.2.5 Определение толщины ГПБЦ
Толщину ГПБЦ определяли на приборе толщинометре CHY-C2 (Германия) предназначенном для определения толщины плёнок, бумаги, картона.
2.2.6 Определение прочности и растяжения ГПБЦ
Исследования проводили при помощи универсальной испытательной машины – XLW (Китай - США). Плёнку размером 20×50 мм зажимали между параллельными горизонтальными держателями и проводили измерения
2.2.7 Приготовление стандартных растворов антибиотиков
Для построения калибровочного графика готовили ряд растворов известной концентрации. Для этого последовательно взвешивали на аналитических весах 0,3; 0,5; 0,7; 0,9 и 1 г исходного антибиотика. Полученные навески помещали в мерную колбу на 100мл и доводили до метки дистиллированной водой при постоянном перемешивании. Таким образом, получали растворы концентрацией 3, 5, 7, 9, и 1 % .
2.2.8 Построение калибровочного графика раствора метронидазола
Метод основан на способности нитрогруппы метронидазола образовывать окрашенные растворы (красно-коричневого цвета) с фенолом в щелочной среде. В пробирки отбирали 1М раствор фенола и 1 М раствор гидроксида калия, ставили на водяную баню и доводили до кипения. После закипания добавляли раствор метронидазола известной концентрации. Параллельно готовили контрольный раствор, содержащий вместо антибиотика дистиллированную воду. В полученных растворах определяли оптическую плотность на приборе СФ UV mini - 1240. По полученным данным построили калибровочный график зависимости оптической плотности(Y) от концентрации раствора антибиотика (X) (рисунок 2.1).
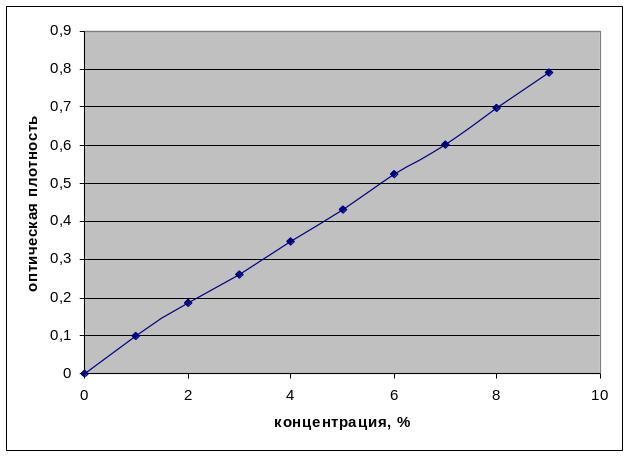
Рисунок 2.1 – Калибровочный график раствора метронидазола
