
- •Содержание, особенности и тенденции развития химической технологии. Химико-технологические системы (хтс). Иерархия химического производства.
- •Основные технологические понятия: производительность, интенсивность, расходные коэффициенты, конверсия, селективность, выход. Химический процесс. Технологический режим.
- •Сырьё для химической технологии. Роль сырья в химической технологии. Классификация сырья. Проблема выбора сырья для технологии органического синтеза.
- •Выбор сырья:
- •Роль воды в химической технологии. Временная и постоянная жесткость. Подготовка воды.
- •Производство водорода. Сырьевые источники. Способы получения водорода. Краткая характеристика и сравнение методов производства водорода.
- •Очистка технологических газов от диоксида углерода. Методы очистки: водными растворами алканоламинов, горячими растворами поташа, холодным метанолом.
- •Очистка технологических газов от монооксида и диоксида углерода, азота, метана. Каталитическое гидрирование (метанирование). Короткоцикловая адсорбция (psa).
- •Энерготехнологическая схема паровой каталитической двухступенчатой конверсии метана и оксида углерода.
- •Термодинамические основы метода синтеза аммиак из азота и водорода. Выбор условий проведения процесса.
- •Энерготехнологическая схема синтеза аммиака при среднем давлении.
- •Физико-химические основы производства разбавленной азотной кислоты. Стадия контактного окисления аммиака.
- •Физико-химические основы производства разбавленной азотной кислоты. Стадия абсорбции диоксида азота водой.
- •Энерготехнологическая схема производства разбавленной азотной кислоты при «дробном» давлении. (комбинированная установка, работающая при 0,4 и 1,0 мПа)
- •Производство карбамида. Выбор условий проведения процесса. Технологические схемы производства карбамида. Блок-схема утилизации газов дистилляции.
- •Тех схемы.
- •Технологическая схема производства карбамида с двухступенчатой дистилляцией плава и жидкостным рециклом.
- •Физико-химические основы производства серной кислоты контактным способом. Основные стадии процесса.
- •Стадия контактного окисления диоксида серы в триоксид при производстве серной кислоты.
- •Технологическая схема производства серной кислоты контактным способом.
- •Производство хлористого водорода различными способами (сульфатный синтез, из элементов, из абгазов хлорорганического синтеза и пиролиза хлорсодержащих соединений).
- •Технологическая схема адиабатической абсорбции хлористого водорода водой.
- •Производство кальцинированной соды аммиачным способом. Химизм процесса. Основные и вспомогательные стадии процесса. Цикл использования аммиака в процессе.
- •Блок-схема процесса производства кальцинированной соды аммиачным способом. Тенденции развития содового производства.
- •Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой.
- •Э лектролиз хлоридов натрия в ваннах с ртутным катодом.
- •Экстракционный способ
Роль воды в химической технологии. Временная и постоянная жесткость. Подготовка воды.
Вода широко используется в химической промышленности. В одних случаях она служит сырьём и реагентом, непосредственно участвующим в химических реакциях, в других – применяется как растворитель, теплоноситель, охлаждающий агент, в третьих – для целого ряда других физических операций – промывка твердых материалов и т.п.
Основные показатели качества воды: жёсткость, общее солесодержание, окисляемость, прозрачность, цвет, запах, реакции.
Жесткость – это свойство воды, обусловленное присутствием в ней солей кальция и магния. Различают временную и постоянную жесткость. Временная жесткость вызывается присутствием в воде растворимых бикарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2 . При кипячении воды эти соли разлагаются, и из раствора выпадает осадок – карбонат кальция или магния. Ca(HCO3)2 = CaCO3+ H2O + CO2 . Постоянная жесткость вызывается присутствием в воде хлоридов, сульфатов и нитратов кальция или магния. При кипячении воды эти соли не удаляются.
Подготовка воды. В зависимости от предъявляемых требований к промышленным водам проводится процесс водоподготовки, состоящий из нескольких операций.
Осветление воды. От взвешенных примесей воду очищают отстаиванием или фильтрацией – обычно через слой песка, гравия и т.п. Для осаждения коллоидных примесей в отстойники вводят коагулянты.
Al2(SO4)3+H2O=3H2SO4+2Al(OH)3; 3Ca(HCO3)2+Al2(SO4)3=3CaSO4+6CO2+2Al(OH)3
Обеззараживание воды. Удаление из неё микроорганизмов и бактерий путем хлорирования или озонирования. Происходит это за счет образующегося атомарного кислорода, обладающим сильными окислительными свойствами, позволяющими убить микроорганизмы.
Ca(ClO)2+CO3+H2O=CaCO3+2HClO; HClO=HCl+O
Умягчение воды. Состоит в полном или частичном удалении из неё солей магния и кальция. Это основной процесс подготовки воды. Способы умягчения воды бывают: физические, химические и физико-химические.
Физические: кипячение и дистилляция
Химические: известково-содовой и фосфатный
Физико-химические: ионнообменные
Известково-содовый метод:
Ca(HCO3)2+Ca(OH)2=2CaCO3+2H2O
Na2CO3+CaCl2=CaCO3+2NaCl
Фосфатный метод:
3CaCl2+2Na3PO4=6NaCl+Ca3(PO4)2
Дегазация – удаление из воды растворенных в ней вредных газов (сероводорода, диоксидов серы и углерода и т.п.), способных вызвать коррозию аппаратуры.
Вопрос №6
Производство водорода. Сырьевые источники. Способы получения водорода. Краткая характеристика и сравнение методов производства водорода.
Почти весь получаемый в промышленности водород образуется в результате реакций окисления углеводородов или углерода связанным или свободным кислородом. Не более 2% водорода получается в результате электролиза воды и другими методами.
Способы получения водорода:
1) Паровая каталитическая конверсия легких углеводородов с подводом тепла. Этим способом конвертируются природный газ, сжиженные газы и бензиновые фракции с температурой кипения до 200оС. Смесь углеводородов и паров воды подаётся в реакционные трубы, находящиеся в топке печи и воспринимающие от неё тепло. Процесс ведется под давлением до 2-4 МПа и при температуре газа на выходе 760-900оС на никелевом кат. Преимущества – низкие энергетические затраты. Недостатки – большие капитальные вложения.
2) Автотермическая каталитическая конверсия легких углеводородов. Этим способом перерабатываются природный, коксовый и некоторые другие газы. Процесс осуществляется в шахтном реакторе с неподвижным слоем никелевого катализатора, куда подается предварительно перемешанная смесь газа, пара и кислорода. Температура на выходе из реактора 800-860оС. Преимущества – низкие удельные капитальные вложения. Недостатки – энергетические затраты. 3) Высокотемпературная кислородная конверсия углеводородов. Процесс представляет собой неполное окисление углеводородов с образованием водорода и оксида углерода. Реакция происходит в свободном объёме при 1300-1500оС под давлением 8-9МПа.Преимущества – низкие кап. затраты. Недостатки – использование высоких температур и давлений и образование сажи.
CnH2n+n=nC+2nH2
4) Газификация твердых топлив (угля, сланцев, торфа). Процесс проводится с подачей в реактор с неподвижным слоем мелкозернистого топлива воздушного, кислородного, паровоздушного и парокислородного дутья под давлением до 0,4МПа при 1300-1500оС. Процессы значительно уступают первым трем названным выше способам, однако используют в качестве сырья неограниченные на сегодня источники.
5) Конверсия биомассы растительного сырья с водой. Конверсия в присутствии кат. протекает по реакции: CxHyOz + xH2O = xH2 + yCO2 . Температура процесса 500-700оС, давление 0,1МПа. Преимущества – низкие энергозатраты. Недостатки – уступает по энергетическим показателям.
6) Электролиз воды и растворов солей. Метод даёт очень чистый водород. Преимущества – простота и надежность технологической схемы. Недостаток – большая энергоёмкость.
7) Извлечение водорода как побочного продукта. Водород получается в ряде процессов нефтепереработки (каталитический реформинг), нефтехимии (производство этилена и ацетилена), коксохимия (коксование углём). Все они дают самый дешёвый водород, так как он является побочным продуктом соответствующих производств. Уделяется серьёзное внимание этому источнику. Разрабатываются эффективные схемы низкотемпературного разделения таких газов и выделения водорода.
Вопрос №7
Блок-схема производства водорода и азотоводородной смеси парокислородовоздушной конверсией метана.
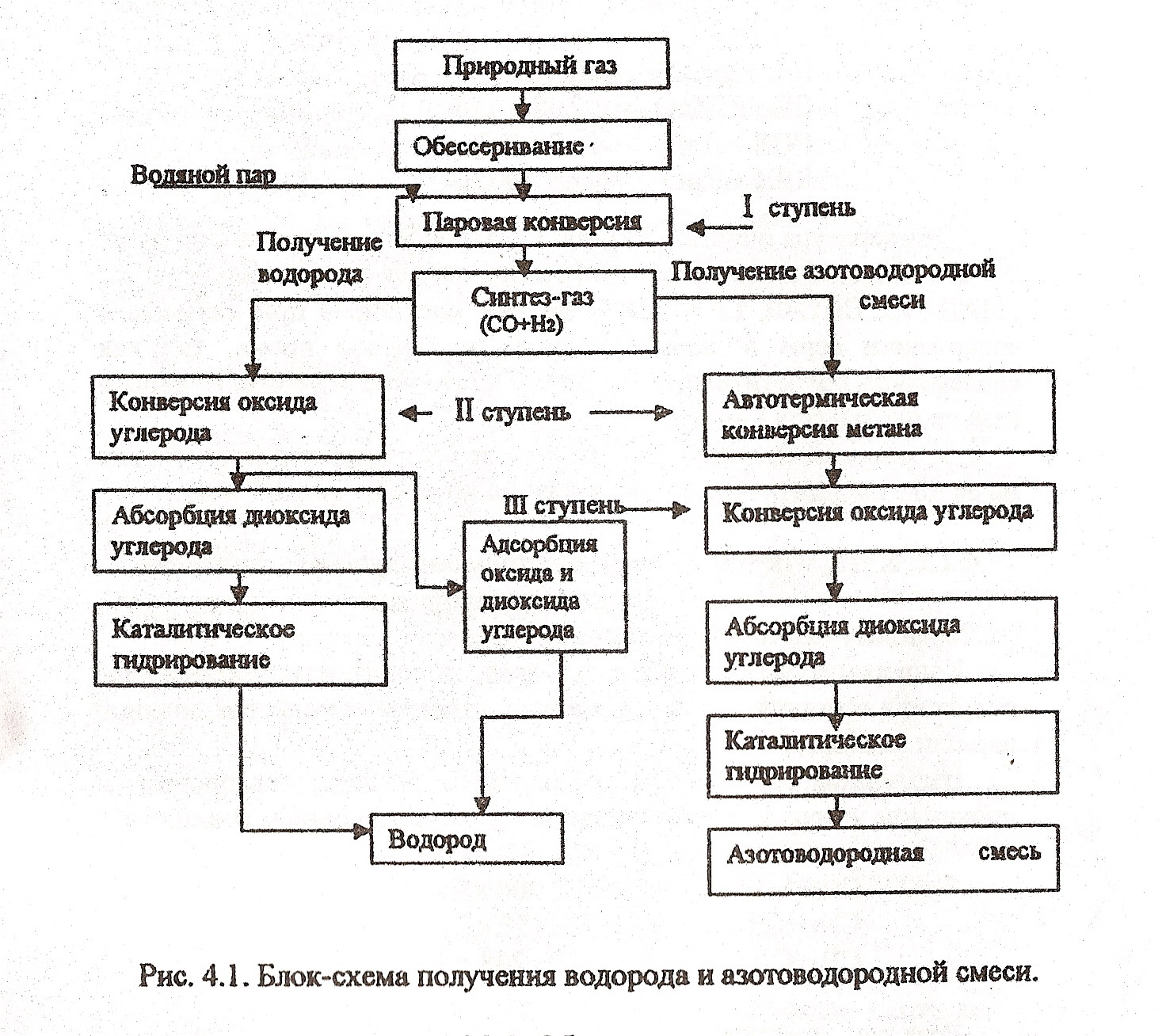
Конкретным сырьём процессов могут служить любые углеводородные газы (природные, попотные и др) нафта и т.д. Для получения 1 т водорода требуется 3,5 - 4,5 т (5-6,6 тыс. м3) природного газа в зависимости от производства (аммиак, метанол, водород)
Вопрос №8
Подготовка сырья для производства водорода парокислородовоздушной конверсией легких углеводородов: «сухие» методы очистки от сернистых соединений.
Стадией подготовки сырья для производства водорода и азотоводородной смеси является обессеривание (хемосорбция) сырья – удаление газообразных сернистых соединений, поскольку они являются сильными каталитическими ядами. Обычный газ, поступающий на установки по производнству водорода, до этого проходит предварительную очистку и не содержит большого количества серы. Однако для проведения ряда технологических процессов количество серы в природном газе не должно превышать 0,5 мг/м3
Очистка оксидом цинка:Большинство современных установок паровой конверсии природного газа снабжены системой очистки поглотителями на основе оксида цинка, способного реагировать помимо сероводорода со многими сернистыми соединениями:
H2S + ZnO = ZnS + H2O;
CS2 + 2ZnO = 2ZnS + CO2;
COS + ZnO = ZnS +CO2;
RSH + ZnO = ZnS + ROH.
Температура очистки 350-400оС. Адсорбент не регенерируется. Остаточное содержание серы в газе не превышает 1 мг/м3. В мировой практике для этой цели используют поглотители на основе оксида цинка, нанесенного на носитель (цемент и др.).
Вопрос №9
Термодинамические основы производства водорода каталитической конверсией углеводородных газов. Выбор условий проведения процесса. Общие требования к катализаторам химико-технологических процессов.
Конверсию углеводородных газов для получения водорода ведут, применяя в качестве окислителя водяной пар или кислород. Взаимодействие метана с вод. паром, кислородом, диоксидом углерода протекает по след.
Реакциям:
CH4 + H2O = CO +3H2 -206кДж; (1)
CH4 + 0,5O2 = CO + 2H2 + 35кДж; (2)
CH4 + CO2 = 2CO + 2H2 – 248кДж; (3)
Далее осуществляется конверсия оксида углерода с водяным паром по реакции:
CO + H2O = CO2 +H2 +41 кДж; (4)
Суммарно процесс конверсии метана с водяным паром протекает в поглощением тепла:
CH4 +2H2O = CO2 + 4H2 -165кДж; (5)
Синтез-газ, образующийся по реакции (3), применяется для получения метанола и других кислородосодержащих органических соединений.
Синтез-газ, образующийся по реакции 1,2,4 пригоден по составу для синтеза аммиака.
В реальных условиях реакции 1 и 4 являются обратимыми.
Выбор условий проведения процессов. Реакция окисления метана водяным паром протекает со значительной скоростью при 1350оС. Из-за трудности ведения эндотермического при столь высоких температурах в промышленных условиях процесс паровой конверсии часто ведут на катализаторе. Увеличение соотношения CH4: H2O c 1:1 до 1:2 увеличивает конверсию метана. Процесс конверсии выгодно проводить при повышенном давлении для увеличения скорости реакции, так как при этом растет концентрация вещества в единице объёма. При повышенном давлении уменьшаются так же объёмы теплообменных и контактных аппаратов и трубопроводов, что очень важно, учитывая что реакции 1 и 2 протекают с увеличением объёма.
К катализаторам паровой конверсии легких углеводородов предъявляют жесткие требования по термоустойчивости и механической прочности. Оцениваются они по комплексу свойств: активности, прочности, гидравлическому сопротивлению, устойчивости при длительной эксплуатации и др. Хороший катализатор должен работать не менее 4-5 лет. Главной особенностью катализатора является высокая каталитическая активность. Активность никелевого катализатора уменьшается при наличии в газе сернистых соединений.
Итак, конверсия легких углеводородов протекает при 760-900оС(на выходе из реактора), при повышенном (до 4МПа) давлении в присутствии избытка водяного пара.
Вопрос №10
Конверсия оксида углерода в процессе производства водорода. Выбор условий проведения процесса. Высокотемпературные и низкотемпературные катализаторы.
Сопутствующая процессам конверсии метана реакция (CO + H2O = CO2 +H2 +41 кДж; (4))
конверсия СО водяным паром – в конверторе метана протекает частично. Эта реакция является желательной, поскольку дальнейшая переработка конвертированного газа в азотоводородную смесь осуществляется путём конверсии оксида углерода.
Условия равновесия этой реакции определяются уравнениями
Кр=(РCO2*PH2O)/(PCO*PH2O);
LgKp=A/T + B.
Из этих уравнений следует, что сдвиг равновесия в сторону образования водорода и, следовательно, увеличение его выхода, могут быть достигнуты повышением концентрации исходных реагентов и снижением температур.
Реакция конверсии СО протекает с выделением тепла, без изменения объёма. Поэтому, согласно принципу Ле-Шателье, понижение температуры благоприятствует более полной конверсии. Конвертированный газ, получаемый после конверсии метана, содержит от 20 до 40 % СО.
В промышленных условиях конверсию проводят при атмосферном и повышенном давлении. Так как в ходе получения реакции изменения объёма газа не происходит, то повышение давления лишь увеличивает скорость процесса, не влияя на равновесный выход водорода. Увеличение содержания водяного пара в газовой смеси способствует более полному протеканию конверсии СО. Повышение температуры смещает влево равновесие реакции конверсии СО, однако при низких температурах реакция протекает очень медленно даже в присутствии катализаторов и выбор температуры зависит от типа применяемого катализатора. В РФ сегодня используются катализаторы двух типов:
1) Катализатор на основе оксида железа с добавлением оксидов хрома. Они работают при 320-470оС, когда скорость реакции достаточна, содержание СО в газовой смеси составляет 2-4%, что требует сложной и громоздкой медноаммиачной очистки от остатков оксида углерода. Это высокотемпературные катализаторы.
2) низкотемпературные цинк-хромовомедные и цинк-хроммедноаллюминевые катализаторы позволяют проводить процесс при 190-250оС и получать остаточное содержание СО в газах 0,2-0,4%. В Этом случае становится возможным применение каталитической очистки методом гидрирования остаточного СО до СН4 (метанирование). Но этот катализатор очень чувствителен к серосодержащим соединениям , что требует высокой степени очистки газа.
Вопрос №11
