
- •Содержание, особенности и тенденции развития химической технологии. Химико-технологические системы (хтс). Иерархия химического производства.
- •Основные технологические понятия: производительность, интенсивность, расходные коэффициенты, конверсия, селективность, выход. Химический процесс. Технологический режим.
- •Сырьё для химической технологии. Роль сырья в химической технологии. Классификация сырья. Проблема выбора сырья для технологии органического синтеза.
- •Выбор сырья:
- •Роль воды в химической технологии. Временная и постоянная жесткость. Подготовка воды.
- •Производство водорода. Сырьевые источники. Способы получения водорода. Краткая характеристика и сравнение методов производства водорода.
- •Очистка технологических газов от диоксида углерода. Методы очистки: водными растворами алканоламинов, горячими растворами поташа, холодным метанолом.
- •Очистка технологических газов от монооксида и диоксида углерода, азота, метана. Каталитическое гидрирование (метанирование). Короткоцикловая адсорбция (psa).
- •Энерготехнологическая схема паровой каталитической двухступенчатой конверсии метана и оксида углерода.
- •Термодинамические основы метода синтеза аммиак из азота и водорода. Выбор условий проведения процесса.
- •Энерготехнологическая схема синтеза аммиака при среднем давлении.
- •Физико-химические основы производства разбавленной азотной кислоты. Стадия контактного окисления аммиака.
- •Физико-химические основы производства разбавленной азотной кислоты. Стадия абсорбции диоксида азота водой.
- •Энерготехнологическая схема производства разбавленной азотной кислоты при «дробном» давлении. (комбинированная установка, работающая при 0,4 и 1,0 мПа)
- •Производство карбамида. Выбор условий проведения процесса. Технологические схемы производства карбамида. Блок-схема утилизации газов дистилляции.
- •Тех схемы.
- •Технологическая схема производства карбамида с двухступенчатой дистилляцией плава и жидкостным рециклом.
- •Физико-химические основы производства серной кислоты контактным способом. Основные стадии процесса.
- •Стадия контактного окисления диоксида серы в триоксид при производстве серной кислоты.
- •Технологическая схема производства серной кислоты контактным способом.
- •Производство хлористого водорода различными способами (сульфатный синтез, из элементов, из абгазов хлорорганического синтеза и пиролиза хлорсодержащих соединений).
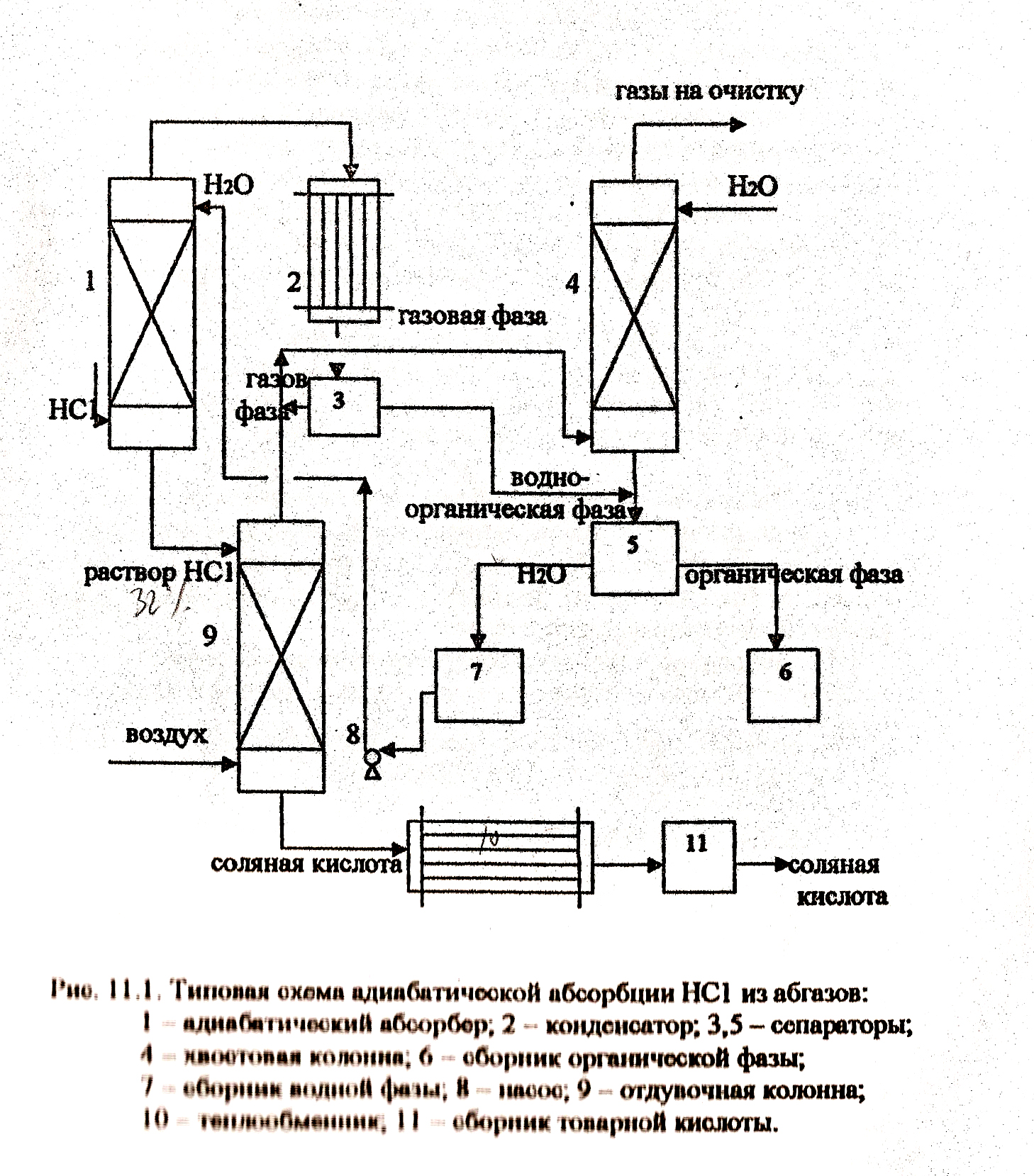
- •Технологическая схема адиабатической абсорбции хлористого водорода водой.
- •Производство кальцинированной соды аммиачным способом. Химизм процесса. Основные и вспомогательные стадии процесса. Цикл использования аммиака в процессе.
- •Блок-схема процесса производства кальцинированной соды аммиачным способом. Тенденции развития содового производства.
- •Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой.
- •Э лектролиз хлоридов натрия в ваннах с ртутным катодом.
- •Экстракционный способ
Технологическая схема адиабатической абсорбции хлористого водорода водой.
Хлористый водород подается в нижнюю часть адиабатического абсорбера (1), где он поглощается водой, подаваемой насосом (8) в его верхнюю часть. Снизу абсорбера выходит 31-32% соляная кислота, которая поступает в отдувочную колонну (9), в низ которой подается воздух. Соляная кислота (28-30%) из куба колонны (9) поступает в теплообменник (10), откуда в сборник товарной кислоты (11). Сверху абсорбера (1) кислые примеси и остатки малорастворимых в воде органических веществ поступают в конденсатор (2) и затем в сепаратор (3). Газовая фаза из сепаратора (3), соединяется с газами отдувочной колонны (9) и подается в нижнюю часть хвостовой колонны (4), где проводится промывка этих газов водой. Сверху колонны (4) газы перед сбросом в атмосферу поступают на дополнительную очистку. Водноорганическая смесь из колонны (4) поступает в сепаратор (5), куда подаются так же жидкие продукты из сепаратора (3). Там она делится на 2 фазы – водную, поступающую в сборник (7) , и органическую, поступающую в сборник (6). Из сборника (7) водная фаза насосом (8) подается на орошение абсорбера (1).
Вопрос № 28
Производство кальцинированной соды аммиачным способом. Химизм процесса. Основные и вспомогательные стадии процесса. Цикл использования аммиака в процессе.
Кальцинированая сода широко используется в производстве мыла и моющих средств, стекла, едкого натра, целлюлозы, химических волокон, алюминия и др продуктов.
Основное количество кальцинированной соды получают аммиачным способом (способ Сольве), разработанный ещё в середине 19 века.
Сырьем для производства кальцинированной соды аммиачным методом является поваренная соль в виде насыщенного водного раствора (рассола), с концентрацией около 300г/л, и известняк (мел) – СаСО3. В качестве вспомогательного применяют аммиак.
Соду получают через промежуточное соединение (бикарбонат натрия).
Хлорид натрия перерабатывается в соду путем реакции обмена, происходящей в водном растворе между двумя солями. Задача состоит в том, чтобы подобрать вторую соль, плохо растворимую в воде. Такой солью, может быть бикарбонат натрия – NaHCO3. Для получения NaHCO3 проводят обменную реакцию между NaCl, находящимся в растворе, и так же хорошо растворимой кислой углекислой солью аммония (бикарбонатом аммония):
NaCl + NH4HCO3 = NaHCO3 + NH4Cl + Q; (1)
Углекислый аммоний не изготовляется отдельно, а получается во время самого процесса насыщенного соляного раствора сначала аммиаком, а потом углекислым газом:
NH3 + H2O + CO2 = NH4HCO3 + Q. (2)
Реакция (1) обратима. Степень превращения NaCl составляет 70-75% и зависит от температуры и концентрации реагирующих веществ.
Полученный NaHCO3 превращают в карбонат натрия при высокой температуре:
2NaHCO3 = Na2CO3 + CO2 + H2O. (3)
Это процесс называется кальцинацией. Наряду с этим проводят и ряд вспомогательных операций, к которым относятся получение углекислого газа и аммиака, необходимых для превращения раствора NaCl в соду. Углекислый газ получается обжигом известняка:
CaCO3 = CaO + CO2. (4)
Выделившийся по реакциям (3) и (4) СО2 направляется на карбонизацию содового раствора.
Аммиак получают обработкой раствора NH4Cl , образующегося по реакции (1) и находящегося в растворе после отделения кристаллического NaHCO3. Раствор нагревают с известняковым молоком:
NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O. (5)
Необходимую для реакции гашеную известь получают при действии на обожженную известь (полученную по реакции(4)) водой:
CaO + H2O = Ca(OH)2. (6)
Полученный по реакции (5) аммиак направляется на насыщение соляного раствора. Т.о. аммиак совершает в производстве замкнутый цикл. Поэтому количество аммиака во время всего процесса должно оставаться постоянным. Свежий аммиак добавляют только для компенсации потерь.
Вопрос № 29
