
- •Калію бромід;
- •Калію хромат;
- •Алкаліметрії;
- •Гліцерином;
- •Натрію хлорид;
- •Амонію оксалату в середовищі кислоти оцтової;
- •Кальцію хлориду;
- •Кислоти;
- •Альдегіди;
- •Нітритометрії;
- •Феруму(ш) хлоридом;
- •Кислотою нітратною;
- •Реактивом Маркі;
- •Натрію хлорид;
- •Комплексонометрії;
- •Імідазолу;
- •Кислоту ацетилсаліцилову;
- •Йодометрія;
- •Срібла нітрату;
- •Барію хлорид;
- •1. Метилоранж
- •4. Крохмаль
- •Натрію хлорид
- •Складних ефірів
- •Ароматичних кислот
Кислоту ацетилсаліцилову;
глюкозу;
кислоту бензойну;
парацетамол;
анестезин.
129. Кислотні властивості кислоти аскорбінової зумовлені наявністю в структурі молекули:
лактонного кільця;
двох енольних гідроксилів;
одного енольного гідроксилу;
фенольних гідроксилів;
подвійного зв'язку.
130. Під час ідентифікації кислоти аскорбінової з нітратом срібла спостерігають:
темно-сірий осад;
жовтий осад;
білий осад;
бурий осад;
синє забарвлення розчину.
131. За ДФУ кальцію глюконат ідентифікують з:
розчином аргентуму нітрату з нітратною кислотою;
феруму (III) хлоридом;
розчином калію перманганату;
реактивом Драгендорфа;
реактивом Маркі.
132. Хімічні властивості та фізіологічну активність кислоти аскорбінової зумовлює:
ендіольне угруповання;
гідроксильні групи;
лактонне кільце;
подвійні зв'язки;
спиртовий гідроксил.
133. Фармакопейним методом кількісного визначення кальцію глюконату є:
Йодометрія;
комплексонометрія;
броматометрія;
нейтралізація;
аргентометрія.
134. Фармакопейною реакцією ідентифікації кислоти аскорбінової є реакція з розчином:
Срібла нітрату;
натрію хлориду;
калію йодату;
натрію тіосульфату;
калію перманганату.
135. Фармакопейним методом кількісного визначення кислоти аскорбінової є:
йодатометрія;
алкаліметрія;
йодометрія;
аргентометрія;
йодхлорметрія.
136. Кислоту аскорбінову зберігають у захищеному від світла місці, тому що вона:
окиснюється;
гідролізує;
відновлюється;
полімеризується;
сублімує.
137. Фізіологічну активність аскорбінової кислоти зумовлює наявність:
подвійних зв'язків;
гідроксильних груп;
лактонного кільця;
ендіольного угруповання;
спиртового гідроксилу.
138. Під час ідентифікації кислоти аскорбінової з 2,6 дихлорфеноліндофенолом спостерігають:
знебарвлення синього розчину;
темно-сірий осад;
жовтий осад;
білий осад;
бурий осад.
139. Розчин калію перманганату знебарвлюється внаслідок взаємодії з розчином:
натрію сульфацилу;
кислоти глутамінової;
анальгіну;
кислоти аскорбінової;
кислоти ацетилсаліцилової.
140. Під час нагрівання левоміцетину з розчином натрію гідроксиду спостерігають:
1) червоне забарвлення;
коричневе забарвлення;
жовте забарвлення, що переходить у червоно-оранжеве;
червоний осад;
жовте забарвлення, що переходить в червоно-оранжеве, після чого утворюється цегляно-червоний осад і з'являється запах амоніаку.
141. Який реактив використовують під час ідентифікації левоміцетину:
Барію хлорид;
натрію гідроксид;
кислоту сірчану концентровану;
кислоту азотну розведену;
кислоту хромотропову?
142. За хімічною класифікацією антибіотик левоміцетин належить до:
препаратів гетероциклічного ряду;
препаратів ароматичного ряду;
аміноглікозидів;
макролідів;
препаратів аліциклічного ряду.
143. Для фармакопейної реакції ідентифікації бензилпеніцилінів використовують сірчанокислий розчин:
кислоти саліцилової;
кислоти азотної;
амонію молібдату;
дифеніламіну;
формальдегіду.
144. Куприметричний метод визначення левоміцетину ґрунтується на утворенні:
розчинної комплексної сполуки;
нерозчинної комплексної сполуки;
аміаку;
молекулярного нітрогену;
лужного середовища.
145. Наявність нітрогрупи в структурі левоміцетину підтверджує:
1) утворення азобарвника після відновлення нітрогрупи;
виділення аміаку під час кип'ятіння з розчином натрію гідроксиду;
поява червоного забарвлення в разі взаємодії з реактивом Маркі;
поява червоного осаду під час нагрівання з розчином натрію гідроксиду;
утворення розчинної комплексної сполуки з купруму(П) сульфатом.
146. Загальною реакцією ідентифікації антибіотиків пеніцилінового ряду є:
утворення індофенолу;
мурексидна проба;
утворення купруму гідроксамату;
реакція Віталі — Морена;
утворення осаду з водню пероксидом.
147. Препарат трихлорметан має назву:
Хлороформ
Фторотан
Йодоформ
Хлоретіл
Анальгін
148. До ароматичних нітросполук можна віднести лікарський засіб:
1. Нітрогліцерин
2. Левоміцетин
3. Анестезин
4. Кислота саліцилова
5. Кислота ацетилсаліцилова
H S


 │ CH3
│ CH3
1

 49.
Препарат, формула якого С6Н5─
О ─ СН2
– С─
N
─ –
49.
Препарат, формула якого С6Н5─
О ─ СН2
– С─
N
─ –
││ CH3
 відноситься до:
відноситься до:
 O
C
= O
O
C
= O
1. Алкалоїдів N
2. Вітамінів ONa
3. Антибіотиків 4. Терпеноїдів
5. Аміноспиртів
150. Препарат, формула якого відноситься до:

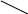
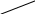
 ОН
ОН
ОН
ОН
Н О
Н – С – ОН О
СН2ОН
Антибіотиків
Карбонових кислот
Терпеноїдів
Алкалоїдів
Вітамінів
151. рН розчину визначають методом:
Рефрактометрії
Хроматографії
Перманганатометрії
Потенціометрії
Нейтралізації
152. Для проведення мурексидної проби використовується суміш реактивів:
Бромна вода, гідроксид амонію
Концентрована нітратна кислота, спиртовий розчин гідроксиду калію
Пергідроль, хлоридна кислота, гідроксид амонію
Хлоридна кислота, дихромат калію
Хлоридна кислота, перманганат калію
153. Для проведення реакції утворення ауринового барвника використовують суміш реактивів:
Концентрована сульфатна кислота, концентрована нітратна кислота
2. Концентрована сульфатна кислота, хлорид заліза ІІІ
3. Концентрована сульфатна кислота, дихромат калію
Концентрована сульфатна кислота, формалін
Концентрована сульфатна кислота, натрію хлорид
154. При дослідженні препаратів води на домішки сульфатів використовують:
Барію хлорид
Натрію хромат
Цинку гідроксид
Червону кров’яну сіль
Натрію гідроксид
155. Недопустимою домішкою в солях натрію є солі:
Хлоридів
Сульфатів
Калію
Кальцію
Амонію
156. Який лікарський засіб кількісно можна визначити йодометрично і алкаліметрично:
1. Натрію цитрат
2. Кислота аскорбінова
3. Кислота хлоридна
4. Натрію бензоат
5. Кислота саліцилова
157. Натрію хлорид в ізотонічному розчині кількісно визначають методом:
Мора
Нітритометрії
Йодометрії
Рефрактометрії
Броматометрії
158. Методом комплексонометрії визначають препарат:
Срібла нітрат
Магнію сульфат
Калію бромід
Натрію бромід
Амонію хлорид
159. Формалін при температурі нижче 9С мутніє за рахунок процесу:
Відновлення
Гідратації
Омилення
Гідролізу
Полімеризації
160. Вихідною речовиною для добування бромідів натрію і калію є:
Бром
Бромоводень
Бромід срібла
Бромід магнію
Бромід кальцію
О
161. Препарати, що містять функціональну групу - С відносяться до:
Ф енолів Н
Альдегідів
Амідів
Кислот
Спиртів
162. Комплексонометрія відноситься до методів:
Фізичних
Хімічних
Біологічних
Фізико-хімічних
Мікрокристалоскопічних
163. Загальною фармакопейною реакцією для ідентифікації антибіотиків пеніцилінового ряду є:
Утворення індофенолу
Мурексидна проба
Утворення гідроксомату міді
Реакція Віталі-Морена
Утворення осаду з пероксидом водню
164. Для ідентифікації срібла нітрату в очних краплях використовують:
Натрію хлорид
Міді сульфат
Амонію нітрат
Реактив Неслера
Сульфатну кислоту
165. Для проведення реакції утворення азобарвника використовують суміш реактивів:
Натрію нітрат з сульфатною кислотою
Натрію нітрат з хлоридною кислотою
Натрію нітрит з хлоридною кислотою
Луг з міді сульфату
Натрію хлорид з нітратною кислотою
166. В якості індикатора в нітритометрії використовується:
