
- •1 Термины и сокращения
- •2 Правила оформления задания на вкр и выдача задания
- •3 Календарный график и порядок контроля выполнения вкр
- •4 Состав вкр
- •4.1 Состав текстовой части проектной вкр
- •4.2 Состав графической части проектной вкр
- •4.3 Состав научно-исследовательской вкр
- •4.4 Иллюстрационный материал научно-исследовательской работы
- •5 Содержание разделов вкр
- •5.1 Содержание разделов рпз проектной вкр
- •Пример расчета материального баланса производства изопропилбензола (ипб)
- •Определение объема реакционной зоны алкилатора Пример расчета теплового баланса алкилатора
- •Толщина теплоизоляции аппарата
- •Пример механического расчета алкилатора
- •Пример расчета вспомогательного оборудования Выбор и расчет насоса
- •5.2 Содержание разделов научно-исследовательской вкр
- •5.3 Содержание разделов комбинированной вкр
- •5.4 Содержание элементов графической части проекта
- •6 Оформление вкр
- •7 Оформление формул
- •8 Оформление иллюстраций
- •9 Построение и оформление таблиц
- •10 Оформление приложений
- •11 Оформление списка литературы
- •12 Оформление графической части вкр
- •13 Выполнение спецификаций к чертежам
- •14 Правила оформления компьютерных презентаций
- •15 Порядок защиты вкр
- •Библиографический список
- •Выпускная квалификационная работа
- •Влияние природы растворителя на каталитическое разложение гидропероксидов
- •Отзыв руководителя выпускной квалификационной работы (проекта)
- •Отзыв рецензента о выпускной квалификационной работе (проекте)
- •420015, Казань, к.Маркса,68
Пример расчета вспомогательного оборудования Выбор и расчет насоса
Рассчитаем насос для подачи возвратного жидкого катализаторного комплекса (ЖАК) из отстойника в алкилатор.
Для подбора насоса определим его основные характеристики.
Расход возвратного катализаторного комплекса 255,83 кг/ч
Плотность ЖАК 1244 кг/м3
Избыточное давление в алкилаторе №7 0,4 МПа
Давление в отстойнике № 17 атмосферное
Геометрическая высота подъема жидкости Нг 3 м
Гидравлическое сопротивление трубопроводов:
всасывающего hвс 1 м
нагнетающего hн 8 м
Объемный расход перекачиваемой жидкости при плотности ЖАК 1244 кг/м3 составляет:
Vτ = mτ/(3600*1244)= 5,71*10-5 м3/с
Полный напор насоса:
Н = Нг + (р2-р1)/(ρ*g) + hвс + hн
Н = 3+0,4*106/(1244*9,81) + 1 + 8 = 44,8 м
Принимая кпд центробежного насоса η = 0,6, определим полезную мощность насоса:
N= Vτ*ρ*g*H/(η*1000)
N=5,71*10-5*1244*9,81*44,8/(0,6*1000) = 0,052 кВт
Мощность электродвигателя принимаем с запасом 25 %. Тогда требуемая мощность насоса составит:
Nдв = 1,25*N = 1,25*0,052 = 0.065 кВт
Полученным данным соответствует центробежный насос марки ГХМ 25/50, установленный на производстве, который в оптимальных условиях работы имеет следующие технические характеристики:
Vτ = 25 м3/ч (0,0069 м3/с)
Н = 50 м.
Насос снабжен электродвигателем ВА 160S2 с номинальной мощностью Nном = 15 кВт, частотой вращения вала 2929 об/мин.
Пример математического моделирования кинетической модели гомогенного процесса - гидратации окиси этилена
Процесс жидкофазной гидратации окиси этилена включает в себя ряд последовательно-параллельных необратимых реакций, приводящих к образованию помимо целевого продукта - моноэтиленгликоля, полигликолей разного строения.
В основе процесса лежат следующие реакции:
kl
сн2 - сн2 + н2О носн2 - сн2он
\ /
О
k2
сн2 - сн2 + носн2 - сн2он носн2 - сн2 - о - сн2 - сн2он
\ /
О
k3
сн2 - сн2 + носн2 - сн2 - о - сн2 - сн2он
\ /
О
носн2 - сн2 - о - сн2 - сн2 - о - сн2 - сн2он
k4
сн2 - сн2 + носн2 - сн2 - о - сн2 - сн2 - о - сн2 - сн2он
\ /
о
носн2- сн2 - о - сн2 - сн2- о - сн2 - сн2 - о - сн2 - сн2он
Процесс можно описать следующей системой кинетических уравнений:
![]()
![]()
![]()
![]()
![]()
![]()
Известно, что константа скорости целевой реакции при 90°С равна k1 = 1,82·10-4 с-1, а константы скорости побочных реакций примерно равны между собой и в 2,55 раз больше k1. Соотношение констант практически не зависит от температуры. Для увеличения скорости целевой реакции при получении моноэтиленгликоля используют большой избыток воды; мольное соотношение окиси этилена к воде составляет 1:15.
Энергия активации целевой реакции равна 19,2 ккал/моль. При помощи уравнения Аррениуса были рассчитаны константа скорости целевой реакции при температуре 140°С, при которой осуществляется процесс гидратации в промышленных условиях k1= 0,275 мин-1 и константы скорости побочных реакций k2 = k3 = k4 = k1 2,55 = 0,701 мин-1.
Используем систему дифференциальных уравнений и полученные значения констант kь k2, k3 и k4 для математического моделирования процесса гидратации окиси этилена при температуре 140°С. Целью моделирования является определение времени, необходимого для достижения максимального выхода моноэтиленгликоля, а также соотношения выходов МЭГ и побочных гликолей.
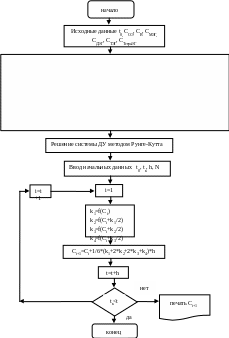
Решение системы дифференциальных уравнений производилось методом Рунге-Кутта с помощью стандартной компьютерной программы. Блок-схема алгоритма расчета приведена на рис. 3. Исходными данными процесса является время начала протекания реакции и время ее окончания, т.е. t0=0; шаг=2 мин.; tк=30 мин. Мольные соотношения концентраций исходных веществ и продуктов: СОЭ=0,0624, СH2O=0,9375, СМЭГ = 0, СДЭГ = 0, СТЭГ = 0, СТетраЭГ = 0. Кинетические кривые расхода реагентов и накопления продуктов приведены на рис. 4, 5.
В результате проведенных расчетов установлено, что выход моноэтиленгликоля асимптотически приближается к максимальному значению и мало изменяется во времени при τ>20 мин.
При τ=24 мин конверсия окиси этилена равна α=99,7 процентов. По заводским данным время нахождения реагентов в реакторе составляет 30 мин, при этом достигается 100–процентная конверсия окиси этилена. Таким образом, предложенная модель может быть использована для кинетического описания процесса гидратации окиси этилена.
нет
Рис. 3 – Блок-схема алгоритма расчета математической модели
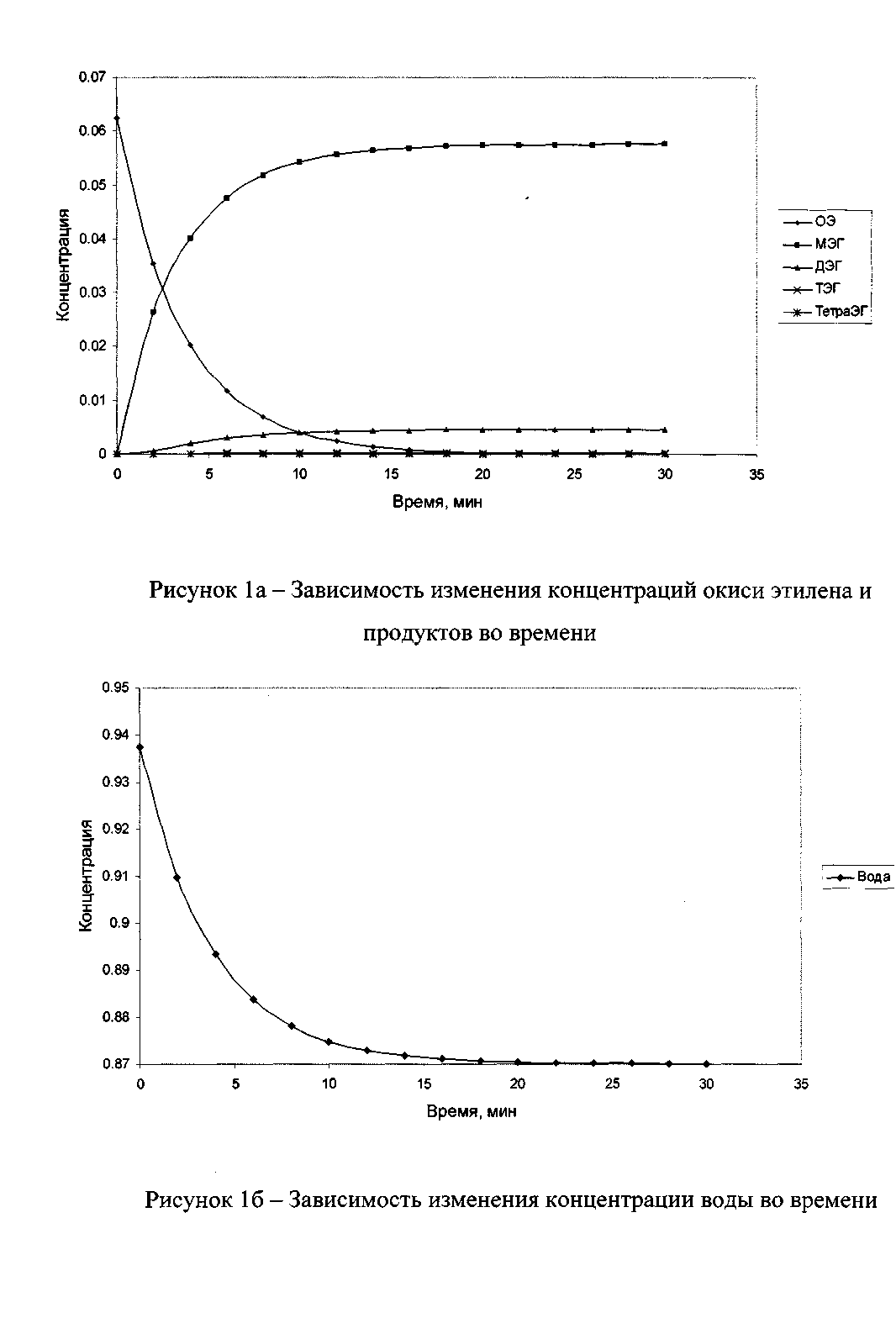
Рис. 4 – Зависимость изменения концентраций окиси этилена и продуктов во времени
Рис. 5 – Зависимость изменения концентраций воды во времени
