- •Основные понятия и законы химии. Современные представления о строении атома.
- •Строение атома.
- •Квантовые числа электронов
- •Периодический закон и периодическая система д.И. Менделеева в свете учения строения атома.
- •Определение, виды, условия образования, природа химической связи.
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Гибридизация орбиталей
- •Определение, механизм образования, свойства ковалентной связи. Валентность. Степень окисления.
- •Оксиды. Определение, классификация, номенклатура, свойства и способы получения.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •Получение
- •Кислоты: определение, классифиакация, номенклатура, свойства и способы получения.
- •Основания: определение, классифиакация, номенклатура, свойства и способы получения.
- •Соли: определение, классификация ,номенклатура, свойства и способы получения.
- •Комплексные соединения: определение, строение по а.Вернеру, типы, номенклатура.
- •Классификация
- •По заряду комплекса
- •]По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура
- •Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •Условия, влияющие на скорость химических реакций
- •Необратимые и обратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Констранта равновесия.
- •Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
- •Дисперсионые системы: определение, классификация. Грубодисперсные системы: суспензии, аэрозоли, эмульсии.
- •Коллоидные растворы: определение, свойства, получение, строение мицелл.
- •Истинные растворы: определение, основыне понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
- •Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
- •Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
- •Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
- •Общая характеристика элементов главной подгруппы VII группы. Медико-биологическое значение галогенов.
- •20 Хлор, хлороводород и соляная кислота. Получение, свойства. Хлориды
- •Получение.
- •Химические свойства.
- •21. Кислородные соединения хлора.
- •Общая характеристика халькогенов. Кислород и его соединения. Медико-биологическое значение кислорода.
- •Кислород, его общая характеристика и нахождения в природе
- •Получение кислорода
- •Химические свойства
- •Фториды кислорода
- •Биологическая роль кислорода
- •Свойства соединений кислорода с водородом (вода, пероксид водорода). Применение н2о2 в медицине. Значение воды.
- •24.Сера. Аллотропия свободной серы. Химические свойства серы. Сероводород. Сероводородная кислота и ее соли.
- •Природные минералы серы
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Получение
- •Соединения, генетически связанные с сероводородом
- •Применение
- •Биологическая активность
- •25. Физические и химические свойства оксидов серы, сернистой и серной кислот, солей сернистой, серной кислот, их применение.
- •Получение
- •]Химические свойства
- •Применение
- •Физиологическое действие
- •Химические свойства
- •Применение
- •Физические и физико-химические свойства
- •Химические свойства
- •Свойства сульфитов
- •Качественные реакции
- •26. Общая характеристика элементов главной подгруппы V группы. Азот и его свойства.
- •Азот. Получение
- •Химические свойства, строение молекулы
- •Промышленное связывание атмосферного азота
- •Соединения азота
- •27. Свойства аммиака и солей аммония. Применение в медицине и фармации.
- •Химические свойства
- •Комплексообразование
- •Биологическая роль
- •Физиологическое действие
- •Применение
- •Получение
- •Аммиак в медицине
- •28. Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение. Список оксидов
- •N(no2)3Тринитрамид
- •N4oНитрозилазид
- •]Воздействие на организм
- •Химические свойства
- •Получение
- •Применение
- •Физиологическое действие
- •29. Физические и химические свойства азотной кислоты. Нитраты. Медико – биологическое значение азота и его соединений.
- •Физические и физико-химические свойства
- •Химические свойства
- •Нитраты
- •30. Характеристика элемента 15 р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
- •Физические свойства
- •31.Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение. Медико-биологическое значение фосфора.
- •Физические свойства
- •]Получение
- •Химические свойства
- •Токсичность
- •Получение
- •Применение
- •Значение фосфора
- •32. Общая характеристика элементов IV группы главной подгруппы. Углерод: строение и физические свойства аллотропов углерода, химические свойства.
- •Физические свойства
- •Графит и алмаз
- •Фуллерены и углеродные нанотрубки
- •Аморфный углерод (строение)
- •Нахождение в природе
- •Химические свойства
- •Неорганические соединения
- •Органические соединения
- •Применение
- •33. Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
- •34. Кремний и его соединения: нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
- •Нахождение в природе
- •Получение
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •35. Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
- •36. Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
- •Получение
- •38. Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
- •Общая характеристика щелочных металлов
- •Химические свойства щелочных металлов
- •Получение щелочных металлов
- •Соединения щелочных металлов Гидроксиды
- •Карбонаты
- •39. Общая характеристика d- элементов. Металлы побочной подгруппы I группы. Соединения меди, серебра. Медико- биологическое значение.
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Соединения меди(I)
- •Химические свойства
- •40. Металлы побочной подгруппы II группы: общая характеристика строения, физические и химические свойства. Медико- биологическое значение
- •Химические свойства:
- •41. Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
- •Получение
- •42. Побочная подгруппа VIII группы: общая характеристика элементов подгруппы, свойства железа и его соединений. Медико-биологическое значение.
- •Получение металлов подгруппы железа
Кислоты: определение, классифиакация, номенклатура, свойства и способы получения.
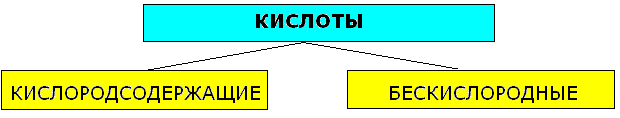
Кислоты-сложные вещества, состоящие из одного или нескольких атомов водорода, способных заместиться на атом металла, и кислотного остатка.Число атомов кислорода определяет основность кислот.
Бескислородные |
Кислородсодержащие |
HCl, HBr, HI, H2S анион "-ид" HCl-хлороводородная(соляная кислота), Cl--хлорид H2S-сероводородная, S2- |
H2SO4, HNO3, H2CO3, H3PO4 и другие. |
ПОЛУЧЕНИЕ.
Кислородсодержащие |
1.Кислотный оксид+вода |
SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 |
2.Металл+сильный окислитель |
P+5HNO3+2H2O=3H3PO4+5NO |
|
3.Cоль+менее летучая кислота |
NaNO3+H2SO4=HNO3 +NaHSO4 |
|
Бескислородные |
1.Водород+неметалл |
H2+Cl2=2HCl |
2.Cоль+менее летучая кислота |
NaCl+H2SO4=2HCl +NaHSO4 |
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
|
|
1.Изменяют окраску индикаторов |
|
лакмус-красный, метилоранж-красный ( только для растворимых кислот) |
|
2.Взаимодействие с металлами, стоящими до водорода |
|
H2SO4+Ca=CaSO4+H2 |
2HCl+Ca=CaCl2+H2 |
2.Взаимодействие с основными оксидами |
|
H2SO4+CaO=CaSO4+H2O |
2HCl+CaO=CaCl2+H2O |
3.Взаимодействие с основаниями |
|
H2SO4+Ca(OH)2=CaSO4+2H2O |
2HCl+Ca(OH)2=CaCl2+2H2O |
4.Взаимодействие с амфотерными оксидами |
|
H2SO4+ZnO=ZnSO4+H2O |
2HCl+ZnO=ZnCl2+H2O |
5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество |
|
H2SO4+BaCl2=BaSO4+2HCl |
2HCl+Na2CO3=2NaCl+H2O+CO2 |
6.При нагревании |
|
Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 |
H2S=H2+S |
Физические свойства кислот |
||
Жидкости H2SO4 HClO4 и др. |
Твердые H3PO4 H2SiO3 и др. |
Газообразные HCl H2S и др. |
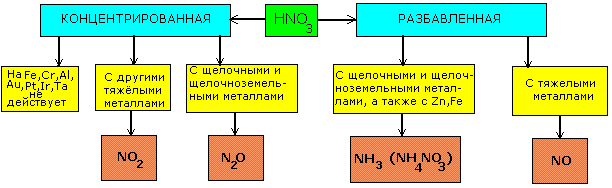
СХЕМА ВЗАИМОДЕЙСТВИЯ АЗОТНОЙ КИСЛОТЫ С МЕТАЛЛАМИ РАЗНОЙ АКТИВНОСТИ |
|
Основания: определение, классифиакация, номенклатура, свойства и способы получения.
Основания-сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН. Физические свойства:твердые кристаллические вещества. В воде растворимы щелочи:LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2, Sr(OH)2,Ba(OH)2, другие-малорастворимы.
Формула |
Название |
Формула |
Название |
LiOH |
гидроксид лития |
Ca(OH)2 |
гидроксид кальция |
NaOH |
гидроксид натрия |
Cu(OH)2 |
гидроксид меди(II) |
KOH |
гидроксид калия |
Fe(OH)2 |
гидроксид железа(III) |
ПОЛУЧЕНИЕ.
Щелочи |
1.Металл+вода |
2Na+2H2O=2NaOH+H2 Ba+2H2O=Ba(OH)2+H2 |
2.Оксид+вода |
Li2O+H2O=2LiOH CaO+H2O=Ca(OH)2 |
|
3.Электролиз растворов щелочных металлов |
2NaCl+2H2O=2NaOH+Cl2+H2 |
|
Нерастворимые основания |
Соль+щелочь |
CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ.
|
|
1.Взаимодействие с кислотами |
|
KOH+HCl=KCl+H2O |
Cu(OH)2+2HCl=CuCl2+2H2O |
2.Взаимодействие с кислотными оксидами |
|
2KOH+CO2=K2CO3+H2O |
не характерны |
3.Действие индикаторов |
|
лакмус-синяя, фенолфталеин-малиновая |
окраска не изменяется |
4.Взаимодействие с амфотерными оксидами |
|
2KOH+ZnO=K2ZnO2+H2O |
не реагируют |
5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание |
|
NaOH+CuCl2=Cu(OH)2+2NaCl |
не реагируют |
6.При нагревании |
|
не разлагаются(кроме LiOH) |
Cu(OH)2=CuO+H2O |
Амфотерные гидроксиды( Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. |
|
Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O |
Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |