
- •Основные понятия и законы химии. Современные представления о строении атома.
- •Строение атома.
- •Квантовые числа электронов
- •Периодический закон и периодическая система д.И. Менделеева в свете учения строения атома.
- •Определение, виды, условия образования, природа химической связи.
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Гибридизация орбиталей
- •Определение, механизм образования, свойства ковалентной связи. Валентность. Степень окисления.
- •Оксиды. Определение, классификация, номенклатура, свойства и способы получения.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •Получение
- •Кислоты: определение, классифиакация, номенклатура, свойства и способы получения.
- •Основания: определение, классифиакация, номенклатура, свойства и способы получения.
- •Соли: определение, классификация ,номенклатура, свойства и способы получения.
- •Комплексные соединения: определение, строение по а.Вернеру, типы, номенклатура.
- •Классификация
- •По заряду комплекса
- •]По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура
- •Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •Условия, влияющие на скорость химических реакций
- •Необратимые и обратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Констранта равновесия.
- •Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
- •Дисперсионые системы: определение, классификация. Грубодисперсные системы: суспензии, аэрозоли, эмульсии.
- •Коллоидные растворы: определение, свойства, получение, строение мицелл.
- •Истинные растворы: определение, основыне понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
- •Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
- •Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
- •Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
- •Общая характеристика элементов главной подгруппы VII группы. Медико-биологическое значение галогенов.
- •20 Хлор, хлороводород и соляная кислота. Получение, свойства. Хлориды
- •Получение.
- •Химические свойства.
- •21. Кислородные соединения хлора.
- •Общая характеристика халькогенов. Кислород и его соединения. Медико-биологическое значение кислорода.
- •Кислород, его общая характеристика и нахождения в природе
- •Получение кислорода
- •Химические свойства
- •Фториды кислорода
- •Биологическая роль кислорода
- •Свойства соединений кислорода с водородом (вода, пероксид водорода). Применение н2о2 в медицине. Значение воды.
- •24.Сера. Аллотропия свободной серы. Химические свойства серы. Сероводород. Сероводородная кислота и ее соли.
- •Природные минералы серы
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Получение
- •Соединения, генетически связанные с сероводородом
- •Применение
- •Биологическая активность
- •25. Физические и химические свойства оксидов серы, сернистой и серной кислот, солей сернистой, серной кислот, их применение.
- •Получение
- •]Химические свойства
- •Применение
- •Физиологическое действие
- •Химические свойства
- •Применение
- •Физические и физико-химические свойства
- •Химические свойства
- •Свойства сульфитов
- •Качественные реакции
- •26. Общая характеристика элементов главной подгруппы V группы. Азот и его свойства.
- •Азот. Получение
- •Химические свойства, строение молекулы
- •Промышленное связывание атмосферного азота
- •Соединения азота
- •27. Свойства аммиака и солей аммония. Применение в медицине и фармации.
- •Химические свойства
- •Комплексообразование
- •Биологическая роль
- •Физиологическое действие
- •Применение
- •Получение
- •Аммиак в медицине
- •28. Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение. Список оксидов
- •N(no2)3Тринитрамид
- •N4oНитрозилазид
- •]Воздействие на организм
- •Химические свойства
- •Получение
- •Применение
- •Физиологическое действие
- •29. Физические и химические свойства азотной кислоты. Нитраты. Медико – биологическое значение азота и его соединений.
- •Физические и физико-химические свойства
- •Химические свойства
- •Нитраты
- •30. Характеристика элемента 15 р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
- •Физические свойства
- •31.Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение. Медико-биологическое значение фосфора.
- •Физические свойства
- •]Получение
- •Химические свойства
- •Токсичность
- •Получение
- •Применение
- •Значение фосфора
- •32. Общая характеристика элементов IV группы главной подгруппы. Углерод: строение и физические свойства аллотропов углерода, химические свойства.
- •Физические свойства
- •Графит и алмаз
- •Фуллерены и углеродные нанотрубки
- •Аморфный углерод (строение)
- •Нахождение в природе
- •Химические свойства
- •Неорганические соединения
- •Органические соединения
- •Применение
- •33. Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
- •34. Кремний и его соединения: нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
- •Нахождение в природе
- •Получение
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •35. Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
- •36. Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
- •Получение
- •38. Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
- •Общая характеристика щелочных металлов
- •Химические свойства щелочных металлов
- •Получение щелочных металлов
- •Соединения щелочных металлов Гидроксиды
- •Карбонаты
- •39. Общая характеристика d- элементов. Металлы побочной подгруппы I группы. Соединения меди, серебра. Медико- биологическое значение.
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Соединения меди(I)
- •Химические свойства
- •40. Металлы побочной подгруппы II группы: общая характеристика строения, физические и химические свойства. Медико- биологическое значение
- •Химические свойства:
- •41. Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
- •Получение
- •42. Побочная подгруппа VIII группы: общая характеристика элементов подгруппы, свойства железа и его соединений. Медико-биологическое значение.
- •Получение металлов подгруппы железа
36. Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементовД. И. Менделеева, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода икремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшеговзаимодействия.
Получение
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Для производства 1000 кг чернового алюминия требуется 1920 кг глинозёма, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодной массы и 17 тыс. кВт·ч электроэнергии постоянного тока.[2]
Алюминий — очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей металл от контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу — гидроксид алюминия:
4 Аl + 3 O2 + 6 Н2О = 4 Аl(ОН)3
Эта реакция сопровождается выделением теплоты.
Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2 Аl + 6 Н2О = 2 Аl(ОН)3 + 3 Н2
Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
2 Аl + 6 НСl = 2 AlСl3 + 3 Н2
2 Аl + 3 Н2SO4 = Аl2(SO4)3 +3 Н2
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8 Аl + 30 НNО3 = 8 Аl(NО3)3 + 3 N2О + 15 Н2О
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными свойствами, алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2 Аl + 6 КОН + 6 Н2О = 2 К3[Аl(ОН)6] + 3 Н2
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание, затем они протекают очень интенсивно и сопровождаются выделением большого количества теплоты:
2 Аl + 3 Вr2 = 2 АlВr3 (бромид алюминия)
4 Аl + 3 O2 = 2 Аl2O3 (оксид алюминия)
2 Аl + 3 S = Аl2S3 (сульфид алюминия)
2 Аl + N2 = 2 АlN (нитрид алюминия)
4 Аl + 3 С = Аl4С3 (карбид алюминия)
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
Аl2S3 + 6 Н2О = 2 Аl(ОН)3 + 3 Н2S
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества теплоты:
8 Al + 3 Fе3О4 = 9 Fе + 4 Аl2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.), а также для сваривания рельсов. Если с помощью специального запала поджечь смесь мелкого порошка алюминия и магнитного железняка Fе3О4 (термит), то реакция протекает самопроизвольно с разогреванием смеси до 3500 °С. Железо при такой температуре находится в расплавленном состоянии.
Применение.
Гидроксид алюминия обладает свойствами поглощать различные вещества, поэтому его применяют при очистке воды.
Сравнительно высокие прочностные характеристики, хорошую тепло- и электропровод-ность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов.
Применяется в авиации, судостроение, машиностроение, нефте- газовой промышленности, строительстве.
Алюминий – это микроэлемент. Содержание в организме: 1*10-5% в сыворотке крови, легких, печени, костях, почках, входит в структуру оболочек нервных клеток головного мозга человека. Принимает участие в построении эпителиальной и соединительной тканей, в процессе регенерации костной ткани, в обмене фосфора.
В медицине применяются:
1. Алюмокалиевые квасцы KAl(SO4)2*12 H2O, обладают вяжущим, прижигающим и кровоостанавливающим действием.
2. Гидроксид алюминия Al(OH) 3 , обладает адсорбирующим и обволакивающим действием, понижает кислотность желудочного сока, входит в состав препарата «Альмагель».
37. Металлы главной подгруппы II группы: общая характеристика, получение, физические и химические свойства. Соли кальция и магния. Жесткость воды. Устранение жесткости воды. Медико-биологическое значение элементов главной подгруппы II группы.
В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов.
Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2. В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее.
Физические и химические свойства элементов главной подгруппы II группы
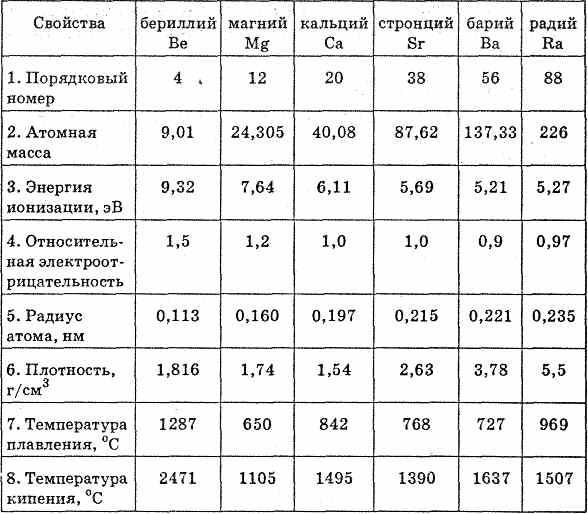
С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства закономерно возрастают. Более ярко они проявляются у щелочноземельных металлов.
Следует отметить, что по своим свойствам бериллий и магний несколько отличаются от щелочноземельных металлов кальция, стронция и бария (последний элемент группы радий отличается от остальных щелочноземельных металлов природными радиоактивными свойствами).
Кальций, стронций и барий окисляются на воздухе до оксидов состава RO, поэтому их хранят без доступа воздуха либо в герметически закрытых сосудах, либо под слоем эфира или керосина. Бериллий и магний при комнатной температуре на воздухе покрываются тонкой оксидной пленкой, предохраняющей их от дальнейшего окисления.
Для получения оксидов этих металлов их необходимо поджечь:
Be+O2=ВеО Кальций, стронций и барий разлагают воду уже при обычной температуре с образованием соответствующих гидроксидов и выделением водорода: R+2H2O=R(OH)2+H2 Гидроксиды щелочноземельных металлов малорастворимы в воде, их растворимость возрастает от Са(ОН)2 к Ва(ОН)2.
Бериллий с водой не взаимодействует, т.к. образующаяся в первый момент пленка малорастворимого гидроксида бериллия Ве(ОН)2 пассивирует металл. Гидроксид бериллия Ве(ОН)2 имеет амфотерный характер:
Be2++2ОН-Ве(ОН)2Н2ВеO22Н++BeO2-2 Однако свойства Ве(ОН)2 как основания выражены гораздо отчетливее кислотных. Магний реагирует с водой лишь при нагревании:
Mg+2Н2O=Mg(OH)2+H2 Гидроксид магния — типичное основание.
При нагревании все металлы главной подгруппы II группы активно реагируют с водородом (давая гидриды RH2, с галогенами, серой, азотом, фосфором, углеродом. Из металлов этой подгруппы наибольшее значение имеют магний и кальций.
Соли магния и особенно кальция входят в состав многих породообразующих минералов. Из этих горных пород наиболее известны мел, мрамор и известняк, основным веществом которых является карбонат кальция. Карбонаты кальция и магния при нагревании разлагаются на соответствующие оксиды и углекислый газ. С водой, содержащей растворенный диоксид углерода, эти карбонаты реагируют, образуя растворы гидрокарбонатов, например:
MCO3
+ CO2
+ H2O
= M2![]() + 2HCO3
+ 2HCO3![]() .
.
При нагревании, и даже при попытке выделить гидрокарбонаты из раствора, удаляя воду при комнатной температуре, они разлагаются по обратной реакции:
M2
+ 2HCO3
= MCO3![]() + CO2
+ CO2![]() + H2O.
+ H2O.
Гидратированный сульфат кальция CaSO4·2H2O представляет собой бесцветное кристаллическое вещество малорастворимое в воде. При нагревании оно частично обезвоживается, переходя в кристаллогидрат состава 2CaSO4·H2O. Тривиальное название двуводного гидрата – гипс, а полуводного – алебастр. При смешивании алебастра с водой он гидратируется, при этом образуется плотная твердая масса гипса. Это свойство алебастра используется в медицине (гипсовые повязки) и строительстве (армированные гипсовые перегородки, заделка дефектов). Скульпторы используют алебастр для изготовления гипсовых моделей и форм.
Карбид (ацетиленид)
кальция CaC2. Структурная формула
(Ca2
)(
C![]() C
).
Получают спеканием негашеной извести
с углем:
C
).
Получают спеканием негашеной извести
с углем:
CaO + 3C = CaC2 + CO
Это ионное вещество не является солью и полностью гидролизуется водой с образованием ацетилена, который долгое время и получали таким способом:
CaC2 + 2H2O = C2H2 + Ca(OH)2.
Гидратированный ион магния [Mg(H2O)6]2 – катионная кислота, поэтому растворимые соли магния подвергаются гидролизу. По этой же причине магний может образовывать основные соли, например, Mg(OH) Cl. Гидратированный ион кальция не является катионной кислотой.
Кальций в соединении может быть обнаружен по окрашиванию пламени. Цвет пламени – оранжево-красный. Качественная реакция на ионы Ca2 , Sr2 и Ba2 , не позволяющая однако различить эти ионы между собой – осаждение соответствующих сульфатов разбавленным раствором серной кислоты (или любым раствором сульфата в кислотной среде):
M2 + SO42 = MSO4 .
Кальций и магний незаменимы для человеческого организма. Кальций обеспечивает усвоение организмом железа, помогает при бессоннице, укрепляет кости и скелет, улучшает функцию нервной системы. Его недостаток приводит к размягчению костей, остеопорозу, порче зубов, чувствительности к стрессам, аллергии, судорогам некоторых групп мышц.
Щелочноземельные металлы. Кальций. Это один из пяти (O,C,H,N,Ca) наиболее распространенных элементов в организме человека (1,5%). Основная масса имеющегося в организме кальция находится в костях и зубах в виде фосфата кальция. Внеклеточный кальций влияет на свертываемость крови, нервно-мышечную возбудимость и сердечную мышцу.
Гексагидрат хлорида кальция CaCl2*6H2O используется при аллергических заболеваниях.
Жженый гипс 2CaSO4*H2O получается путём прокаливания природного гипса. При замачивании в воде он быстро твердеет. На этом свойстве основано его использование при изготовлении гипсовых повязок. В стоматологии применяется в качестве слепочного материала при протезировании зубов.
Жёсткость воды и способы её устранения.
Растворимые соли кальция и магния обуславливают общую жёсткость воды. Если они присутствуют в воде в небольших количествах, то вода называется мягкой. При нагревании кислые карбонаты кальция и магния разлагаются и переходят в нерастворимые основные карбонаты: Са(НСО3) = Н2О + СО2 + СаСО3↓ Растворимость сульфата кальция СаSO4 при нагревании также снижается, поэтому он входит в состав накипи. Жёсткость, вызванная присутствием в воде кислых карбонатов кальция и магния, называется карбонатной или временной, так как она может быть устранена. Помимо карбонатной жёсткости, различают ещё некарбонатную жёсткость, которая зависит от содержания в воде ЭСl2 и ЭSO4, где Э – Са, Мg. Эти соли не удаляются при кипячении, и поэтому некарбонатную жёсткость называют также постоянной жёсткостью. Карбонатная и некарбонатная жёсткость в сумме дают общую жёсткость. Для полного ее устранения воду иногда перегоняют. Но это дорого. Для устранения карбонатной жёсткости воду можно прокипятить, но это тоже дорого и образуется накипь. Жёсткость удаляют прибавлением соответствующего количества Са(ОН)2: Са(ОН)2 + Са(НСО3)2 = СаСО3↓ + 2Н2О. Общую жёсткость устраняют или добавлением Na2CO3, или при помощи так называемых катионитов. При использовании углекислого натрия растворимые соли кальция и магния тоже переводят в нерастворимые карбонаты: Са2+ + Na2CO3 = 2Na+ + CaCO3↓. Устранение жёсткости при помощи катионитов – процесс более совершенный. Катиониты – высокомолекулярные натрийсодержащие органические соединения, состав которых можно выразить формулой Na2R, где R – сложный кислотный остаток. При фильтровании воды через слой катионита происходит обмен катионов Na+ кристаллической решетки на катионы Са2+ и Mg2+ из раствора по схеме: Са2+ + Na2R = 2Na+ + CaR. Следовательно, ионы Са из раствора переходят в катионит, а ионы Na+ переходят из катионита в раствор. Для восстановления использованного катионита его промывают концентрированным раствором поваренной соли. При этом происходит обратный процесс: ионы Са2+ в кристаллической решетке в катионита заменяются на ионы Na+ из раствора. Регенерированный катионит снова применяют для очистки воды. Подобным образом работают фильтры на основе пермутита:
магний Na2[Al2Si2O8] + Ca2+ = 2Na+ + Ca[Al2Si2O8]
