
- •Основные понятия и законы химии. Современные представления о строении атома.
- •Строение атома.
- •Квантовые числа электронов
- •Периодический закон и периодическая система д.И. Менделеева в свете учения строения атома.
- •Определение, виды, условия образования, природа химической связи.
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Гибридизация орбиталей
- •Определение, механизм образования, свойства ковалентной связи. Валентность. Степень окисления.
- •Оксиды. Определение, классификация, номенклатура, свойства и способы получения.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •Получение
- •Кислоты: определение, классифиакация, номенклатура, свойства и способы получения.
- •Основания: определение, классифиакация, номенклатура, свойства и способы получения.
- •Соли: определение, классификация ,номенклатура, свойства и способы получения.
- •Комплексные соединения: определение, строение по а.Вернеру, типы, номенклатура.
- •Классификация
- •По заряду комплекса
- •]По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура
- •Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •Условия, влияющие на скорость химических реакций
- •Необратимые и обратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Констранта равновесия.
- •Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
- •Дисперсионые системы: определение, классификация. Грубодисперсные системы: суспензии, аэрозоли, эмульсии.
- •Коллоидные растворы: определение, свойства, получение, строение мицелл.
- •Истинные растворы: определение, основыне понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
- •Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
- •Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
- •Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
- •Общая характеристика элементов главной подгруппы VII группы. Медико-биологическое значение галогенов.
- •20 Хлор, хлороводород и соляная кислота. Получение, свойства. Хлориды
- •Получение.
- •Химические свойства.
- •21. Кислородные соединения хлора.
- •Общая характеристика халькогенов. Кислород и его соединения. Медико-биологическое значение кислорода.
- •Кислород, его общая характеристика и нахождения в природе
- •Получение кислорода
- •Химические свойства
- •Фториды кислорода
- •Биологическая роль кислорода
- •Свойства соединений кислорода с водородом (вода, пероксид водорода). Применение н2о2 в медицине. Значение воды.
- •24.Сера. Аллотропия свободной серы. Химические свойства серы. Сероводород. Сероводородная кислота и ее соли.
- •Природные минералы серы
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Получение
- •Соединения, генетически связанные с сероводородом
- •Применение
- •Биологическая активность
- •25. Физические и химические свойства оксидов серы, сернистой и серной кислот, солей сернистой, серной кислот, их применение.
- •Получение
- •]Химические свойства
- •Применение
- •Физиологическое действие
- •Химические свойства
- •Применение
- •Физические и физико-химические свойства
- •Химические свойства
- •Свойства сульфитов
- •Качественные реакции
- •26. Общая характеристика элементов главной подгруппы V группы. Азот и его свойства.
- •Азот. Получение
- •Химические свойства, строение молекулы
- •Промышленное связывание атмосферного азота
- •Соединения азота
- •27. Свойства аммиака и солей аммония. Применение в медицине и фармации.
- •Химические свойства
- •Комплексообразование
- •Биологическая роль
- •Физиологическое действие
- •Применение
- •Получение
- •Аммиак в медицине
- •28. Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение. Список оксидов
- •N(no2)3Тринитрамид
- •N4oНитрозилазид
- •]Воздействие на организм
- •Химические свойства
- •Получение
- •Применение
- •Физиологическое действие
- •29. Физические и химические свойства азотной кислоты. Нитраты. Медико – биологическое значение азота и его соединений.
- •Физические и физико-химические свойства
- •Химические свойства
- •Нитраты
- •30. Характеристика элемента 15 р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
- •Физические свойства
- •31.Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение. Медико-биологическое значение фосфора.
- •Физические свойства
- •]Получение
- •Химические свойства
- •Токсичность
- •Получение
- •Применение
- •Значение фосфора
- •32. Общая характеристика элементов IV группы главной подгруппы. Углерод: строение и физические свойства аллотропов углерода, химические свойства.
- •Физические свойства
- •Графит и алмаз
- •Фуллерены и углеродные нанотрубки
- •Аморфный углерод (строение)
- •Нахождение в природе
- •Химические свойства
- •Неорганические соединения
- •Органические соединения
- •Применение
- •33. Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
- •34. Кремний и его соединения: нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
- •Нахождение в природе
- •Получение
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •35. Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
- •36. Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
- •Получение
- •38. Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
- •Общая характеристика щелочных металлов
- •Химические свойства щелочных металлов
- •Получение щелочных металлов
- •Соединения щелочных металлов Гидроксиды
- •Карбонаты
- •39. Общая характеристика d- элементов. Металлы побочной подгруппы I группы. Соединения меди, серебра. Медико- биологическое значение.
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Соединения меди(I)
- •Химические свойства
- •40. Металлы побочной подгруппы II группы: общая характеристика строения, физические и химические свойства. Медико- биологическое значение
- •Химические свойства:
- •41. Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
- •Получение
- •42. Побочная подгруппа VIII группы: общая характеристика элементов подгруппы, свойства железа и его соединений. Медико-биологическое значение.
- •Получение металлов подгруппы железа
33. Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
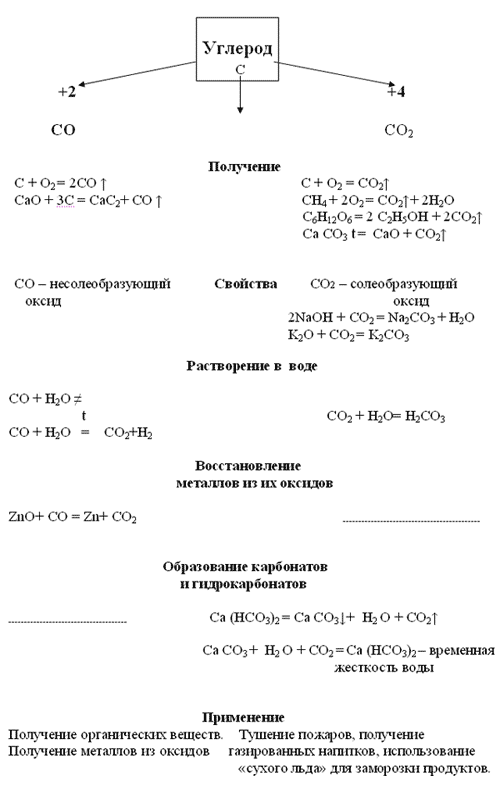
Кислородные соединения углерода Углерод образует два оксида — СО и С02.
Оксид углерода(II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), лишая тем самым возможности гемоглобин переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов.
Оксид СО относят, как вы уже знаете, к несолеобразующим оксидам, так как, будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается.
СО — хороший восстановитель. Он сгорает в кислороде, образуя углекислый газ: 2СО + 02 = 2С02
Оксид углерода(II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
Fе203 + ЗСО = 2Fе + ЗС02
Именно это свойство оксида углерода(II) используется в металлургии при выплавке чугуна.
Оксид углерода(IV) С02 — широко известный под названием углекислый газ — бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, — это известный вам сухой лед, который применяется для хранения пищевых продуктов.
С02 — это типичный кислотный оксид: взаимодействует со щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
С02 + 2Мg = 2МgO + С
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислоты:
СаС03 + 2НСl = СаСl2 + Н20 + С02
В промышленности большие количества углекислого газа получают обжигом известняка: СаС03 = СаО + СO2
Углекислый газ, кроме уже названной области применения, используют также для изготовления шипучих напитков и для получения соды.
При растворении оксида углерода(IV) в воде образуется угольная кислота Н2С03, которая очень нестойкая и легко разлагается на исходные компоненты — углекислый газ и воду:
CO2 + Н20 —> H2CO3
Равновесие этой реакции смещено влево.
Как двухосновная кислота она образует два ряда солей: средние — карбонаты и кислые — гидрокарбонаты. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
СаС03 + Н20 + С02 = Са(НС03)2
Именно наличием этой соли и объясняется временная жесткость воды. При нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
Са(НС03)2 = СаС03 + Н20 + С02
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников, а в природе в результате этой реакции формируются в пещерах свисающие вниз. Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жесткость. Кипячением постоянную жесткость воды устранить нельзя. Приходится использовать другой карбонат — соду Nа2С03, которая переводит эти ионы Са2+ в осадок, например:
СаСl2 + Na2С03 = СаС034- + 2NаСl
Соду можно использовать и для устранения временной жесткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа:
CO + 2Н+ = Н20 + С02 НС03 + Н+ = Н20 + С02
Эта реакция является качественной реакцией на соли угольной кислоты.
Углерод, обладая исключительной способностью образовывать вместе с другими элементами длинные цепи атомов, дает многочисленное разнообразие органических соединений. Благодаря углероду возникло все богатство и разнообразие видов растений и животных.
В настоящее время широко обсуждаются вопросы загрязнения биосферы диоксидом углерода, поступающим из продуктов сжигания топлива. Увеличение концентрации CO2 в воздухе на 20% может вызвать глобальное повышение температуры на Земле на 4-50С – «Парниковый эффект».
Особенно вредное действие на организм человека оказывает оксид углерода (II) или угарный газ. При вдыхании оксид углерода (II) попадает в кровь и образует прочное соединение с гемоглобином – карбоксигемоглобин. При этом гемоглобин теряет способность связывать кислород, что и является причиной смерти при тяжелых отравлениях угарным газом.
В медицине применяется:
1. Активированный уголь (карболен); адсорбент при отравлениях алкалоидами, солями тяжелых металлов и т.д.; находит широкое применение в хемосорбции.
2. Гидрокарбонат натрия NaHCO3 ; понижает кислотность желудочного сока; водные растворы используются для полосканий и примочек.
