
- •Основные понятия и законы химии. Современные представления о строении атома.
- •Строение атома.
- •Квантовые числа электронов
- •Периодический закон и периодическая система д.И. Менделеева в свете учения строения атома.
- •Определение, виды, условия образования, природа химической связи.
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Гибридизация орбиталей
- •Определение, механизм образования, свойства ковалентной связи. Валентность. Степень окисления.
- •Оксиды. Определение, классификация, номенклатура, свойства и способы получения.
- •Химические свойства Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •Получение
- •Кислоты: определение, классифиакация, номенклатура, свойства и способы получения.
- •Основания: определение, классифиакация, номенклатура, свойства и способы получения.
- •Соли: определение, классификация ,номенклатура, свойства и способы получения.
- •Комплексные соединения: определение, строение по а.Вернеру, типы, номенклатура.
- •Классификация
- •По заряду комплекса
- •]По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Номенклатура
- •Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
- •Условия, влияющие на скорость химических реакций
- •Необратимые и обратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Констранта равновесия.
- •Окислительно-восстановительные реакции: определение, основные понятия, сущность окисления и восстановления, важнейшие окислители и восстановители реакции.
- •Дисперсионые системы: определение, классификация. Грубодисперсные системы: суспензии, аэрозоли, эмульсии.
- •Коллоидные растворы: определение, свойства, получение, строение мицелл.
- •Истинные растворы: определение, основыне понятия, сущность процесса растворения. Диффузия. Осмос. Осмотическое давление.
- •Основные положения теории электролитической диссоциации. Механизм электролитической диссоциации. Степень и константа диссоциации.
- •Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
- •Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
- •Общая характеристика элементов главной подгруппы VII группы. Медико-биологическое значение галогенов.
- •20 Хлор, хлороводород и соляная кислота. Получение, свойства. Хлориды
- •Получение.
- •Химические свойства.
- •21. Кислородные соединения хлора.
- •Общая характеристика халькогенов. Кислород и его соединения. Медико-биологическое значение кислорода.
- •Кислород, его общая характеристика и нахождения в природе
- •Получение кислорода
- •Химические свойства
- •Фториды кислорода
- •Биологическая роль кислорода
- •Свойства соединений кислорода с водородом (вода, пероксид водорода). Применение н2о2 в медицине. Значение воды.
- •24.Сера. Аллотропия свободной серы. Химические свойства серы. Сероводород. Сероводородная кислота и ее соли.
- •Природные минералы серы
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •Физические свойства
- •Химические свойства
- •Сульфиды
- •Получение
- •Соединения, генетически связанные с сероводородом
- •Применение
- •Биологическая активность
- •25. Физические и химические свойства оксидов серы, сернистой и серной кислот, солей сернистой, серной кислот, их применение.
- •Получение
- •]Химические свойства
- •Применение
- •Физиологическое действие
- •Химические свойства
- •Применение
- •Физические и физико-химические свойства
- •Химические свойства
- •Свойства сульфитов
- •Качественные реакции
- •26. Общая характеристика элементов главной подгруппы V группы. Азот и его свойства.
- •Азот. Получение
- •Химические свойства, строение молекулы
- •Промышленное связывание атмосферного азота
- •Соединения азота
- •27. Свойства аммиака и солей аммония. Применение в медицине и фармации.
- •Химические свойства
- •Комплексообразование
- •Биологическая роль
- •Физиологическое действие
- •Применение
- •Получение
- •Аммиак в медицине
- •28. Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение. Список оксидов
- •N(no2)3Тринитрамид
- •N4oНитрозилазид
- •]Воздействие на организм
- •Химические свойства
- •Получение
- •Применение
- •Физиологическое действие
- •29. Физические и химические свойства азотной кислоты. Нитраты. Медико – биологическое значение азота и его соединений.
- •Физические и физико-химические свойства
- •Химические свойства
- •Нитраты
- •30. Характеристика элемента 15 р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
- •Физические свойства
- •31.Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение. Медико-биологическое значение фосфора.
- •Физические свойства
- •]Получение
- •Химические свойства
- •Токсичность
- •Получение
- •Применение
- •Значение фосфора
- •32. Общая характеристика элементов IV группы главной подгруппы. Углерод: строение и физические свойства аллотропов углерода, химические свойства.
- •Физические свойства
- •Графит и алмаз
- •Фуллерены и углеродные нанотрубки
- •Аморфный углерод (строение)
- •Нахождение в природе
- •Химические свойства
- •Неорганические соединения
- •Органические соединения
- •Применение
- •33. Кислородные соединения углерода: строение молекул, физические и химические свойства. Медико- биологическое значение углерода и его соединений.
- •34. Кремний и его соединения: нахождение в природе, получение, физические и химические свойства. Медико - биологическое значение кремния.
- •Нахождение в природе
- •Получение
- •Физические свойства
- •Химические свойства
- •Биологическая роль
- •35. Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
- •36. Алюминий и его соединения: получение, физические и химические свойства. Медико-биологическое значение алюминия.
- •Получение
- •38. Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
- •Общая характеристика щелочных металлов
- •Химические свойства щелочных металлов
- •Получение щелочных металлов
- •Соединения щелочных металлов Гидроксиды
- •Карбонаты
- •39. Общая характеристика d- элементов. Металлы побочной подгруппы I группы. Соединения меди, серебра. Медико- биологическое значение.
- •Химические свойства Возможные степени окисления
- •Простое вещество
- •Соединения меди(I)
- •Химические свойства
- •40. Металлы побочной подгруппы II группы: общая характеристика строения, физические и химические свойства. Медико- биологическое значение
- •Химические свойства:
- •41. Побочные подгруппы VI,VII группы: общая характеристика элементов подгруппы, свойства хрома, марганца и их соединений. Медико- биологическое значение.
- •Получение
- •42. Побочная подгруппа VIII группы: общая характеристика элементов подгруппы, свойства железа и его соединений. Медико-биологическое значение.
- •Получение металлов подгруппы железа
Скорость химической реакции. Факторы, влияющие на скорость химической реакции.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятиемхимической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
![]()
выражение для скорости будет выглядеть так:
![]() .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:

Здесь γ (греческая буква «гамма») - так называемый температурный коэффициент или коэффициент Вант-Гоффа, kt и kt+10 – константы скорости реакции при температурах t и (t + 10) оС. Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
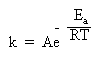
Здесь k – константа скорости, e – важное в математике число (равное приблизительно 2,71 и возникающее во многих математических преобразованиях), R – газовая постоянная, T – абсолютная температура в Кельвинах (об R и T см. в §5.6 книги 1), Ea – энергия активации. Еще одна постоянная А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т.е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы — вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример — бурное разложение перекиси водорода при добавлении катализатора — оксида марганца (IV):
2H2O2 = 2H2O + O2↑
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы — вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров:
Условия |
|
|
Природа реагирующих веществ |
Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑ |
|
Их концентрация |
Чистая перекись водорода разлагается со взрывом, а в растворе — за несколько месяцев |
|
Температура |
В прохладном месте раствор Н2О2 сохраняется довольно долго |
|
Присутствие катализаторов и ингибиторов |
Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO2 в качестве катализатора — происходит бурное выделение кислорода |
|
