
Федеральное агентство по образованию
ГОУ ВПО МГСУ
Технические процессы и производства
КУРСОВАЯ РАБОТА
«Расчёт адсорбционной установки»
Выполнил:
Студент: Шибанов И.А.
Факультет: ИСТАС
Курс: 3
Группа: 4
Научный руководитель:
Москва 2011 г.
Оглавление.
Оглавление
1)Теоретическая часть. 3
Основные термины и определения. 3
Природа адсорбции и виды адсорбентов 6
Краткие сведения об адсорбентах 10
2)Практическая часть. 18
Адсорбционное очистки атмосферного воздуха. 18
Конкретный расчет адсорбционной установки. 24
Заключение 32
Список используемой литературы 33
1)Теоретическая часть. Основные термины и определения.
Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз.
Адсорбент - твердое тело, используемое в качестве средства очистки (разделения).
Адсорбтив – вещество, подлежащее удалению для достижения эффекта очистки (разделения).
Объёмная фаза – среда, подвергаемая очистке (разделению). Она представляет собой жидкость или газ.
Адсорбционный процесс заключается в приведении в контакт объемной фазы и адсорбента, в ходе которого нежелательные молекулы объемной фазы поглощаются адсорбентом, а объемная фаза становится чистой.
Это описание процесса адсорбционной очистки предполагает, что подвергаемая очистке объемная фаза представляет собой смесь компонентов, один из которых поглощается лучше, чем другой. Различия в адсорбируемости компонентов вытекают из различий в свойствах, строении и структуре молекул объемной фазы, взаимодействующих с адсорбентом. Свое проявление эти различия находят в адсорбционной емкости, которая характеризует способность единичной массы (объема) адсорбента поглощать компоненты очищаемой среды.
Коэффициент распределения адсорбата – обозначив величину адсорбции через X, а концентрацию в объёмной фазе через C и разделив первое на второе мы получим коэффициент K (K = X/C), который и является коэффициентом распределения адсорбата. В системах адсорбент - адсорбат коэффициент распределения зависит от типа системы и условий, в которых она находиться; он лежит в пределах 101- 106 и выше. Отношение коэффициентов распределения двух адсорбатов, находящихся в смеси, называют коэффициентом разделения. Коэффициенты распределения и разделения можно рассматривать в качестве меры адсорбируемости компонентов, которая возрастает при их увеличении. Если в некоторой системе коэффициенты распределения различаются на порядок и более, то считают, что адсорбция всех компонентов многокомпонентной смеси, кроме адсорбции вещества с наибольшим значением коэффициента распределения (будем далее называть его целевым), пренебрежимо мала. В этом часто встречающемся случае вместо адсорбции многокомпонентной смеси можно рассматривать индивидуальную адсорбцию целевого компонента.
Зависимость равновесной величины индивидуальной адсорбции вещества (целевого компонента) при постоянной температуре от его содержания в объемной фазе называют изотермой адсорбции. Зависимость от температуры при постоянном содержании (парциальном давлении) – изопикной (изобарой) адсорбции. Зависимость равновесного давления от температуры при постоянной величине адсорбции носит название изостеры адсорбции.
Поддержание постоянной температуры обеспечивается легче, чем поддержание постоянного содержания в любой из фаз. Поэтому экспериментальный материал по адсорбции обычно получают в виде изотерм. Они же часто являются первичным объектом теоретического анализа. На рис.1 приведены типичные изотермы адсорбции. Из рисунка видно, что величина адсорбции (Х) возрастает по мере увеличения концентрации (С) (парциального давления, Р) адсорбата и убывает с ростом температуры (Т).
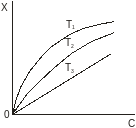
Рис.1.Изотермы адсорбции: T1<T2<T3.
Теоретическая интерпретация изотерм, приведенных на рис.1, для адсорбции на плоской поверхности адсорбента впервые была выполнена американским физиком Ленгмюром и по его имени изотермы такого типа, которые показаны на рисунке, стали называть ленгмюровскими (синоним: выпуклыми). Они очень часто встречаются в адсорбционных системах даже в тех случаях, когда допущения теории Ленгмюра не выполняются или выполняются не полностью. Уравнение Ленгмюра записывается так:
X = XmbC/(1 + bC), (1.1)
где Xm – предельная величина адсорбции, отвечающая плато на изотерме, b – коэффициент, имеющий смысл константы равновесия.
При наличии изотерм адсорбции изопикны - изобары адсорбции получают путем сечения семейства изотерм вертикальными линиями, отвечающими условию С = const. Изостеры адсорбции получают путем сечения изотерм горизонтальными линиями, отвечающими условию: Х = const. Координаты точек пересечения вертикальных прямых с изотермами дают изопикны адсорбции, а пересечения горизонтальных линий с теми же изотермами – изостеры.
На рис.1.2 а приведены изостеры адсорбции в координатах С ~ T. На рис.1.2 б эти же изостеры представлены в координатах линейной формы уравнения Клапейрона-Клаузиуса:
LnC ~ - ΔH/RT, (1.2)
где ΔН – теплота адсорбции, кДж/моль; R – газовая постоянная, кДж/моль.К. По тангенсу угла наклона линейных в указанных координатах изостер адсорбции вычисляют изостерическую теплоту адсорбци, т.е. теплоту адсорбции при постоянной величине адсорбции.

Рис.1.2.Изостеры адсорбции: а – в обычных координатах, б – в координатах уравнения Клапейрона - Клаузиуса, X.1>X2>X3.
Одновременное использование изотерм и изостер адсорбции позволяет определить два важнейших свойства системы: величину и теплоту адсорбции. Отметим, что адсорбция – процесс экзотермичный и ее протекание всегда сопровождается выделением тепла.
