
- •1. Роль белков в жизнедеятельности организмов. Белки- коллоидные гидрофилы.
- •2. Классификация белков по растворимости и по функциям
- •3. Простые и сложные белки, их характеристика.
- •4. Строение, свойства и классификация аминокислот.
- •5. Уровни структурной организации.
- •6. Связи, стабилизирующие структуру белка.
- •7. Физико-химические свойства белков.
- •8. Механизм возникновения заряда.
- •9. Факторы, влияющие на заряд. Электрофорез белков
- •10. Изоэлектрическая точка белков.
- •11. Денатурация белков.
- •12. Гидролиз белков.
- •13. Строение и свойства ферментов.
- •14. Кинетика ферментативных реакций.
- •15. Факторы, влияющие на ферментативную активность
- •16. Специфичность действия ферментов.
- •17. Активаторы и ингибиторы ферментов.
- •18. Механизм действия ферментов.
- •19. Изоферменты. Исследование активности ферментов для диагностики заболевания.
- •20. Механизм регуляции биохимических процессов в организме
- •21. Ферментопатии. Применение ферментов в медицине.
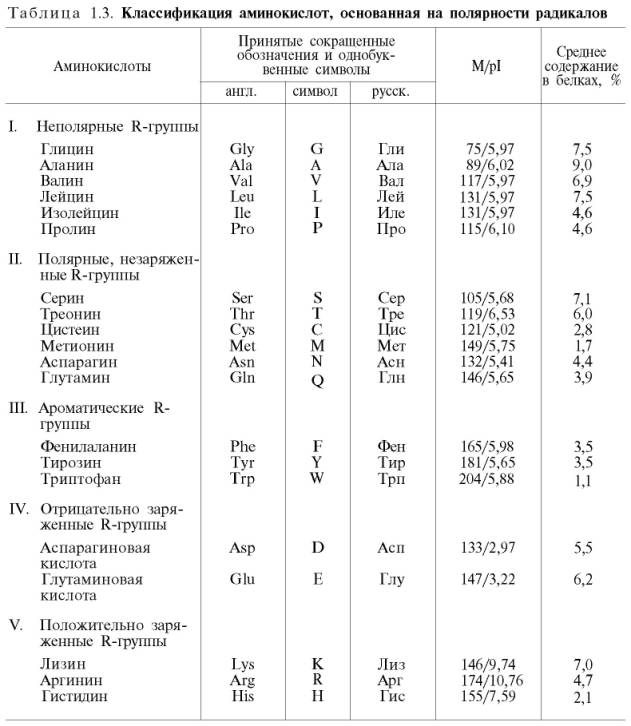
4. Строение, свойства и классификация аминокислот.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Общую структурную формулу любой аминокислоты можно представить следуорганизмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотикови т. д.; дигидроксифенилаланин (ДОФА) и g-аминомасляная кислота служат посредниками при передаче нервных импульсов.
Аминокислоты регулируют секреторную функцию желудка, печени, поджелудочной железы, кишечника, принимают участие в кроветворении, обладают детоксицирующими свойствами, регулируют аппетит, повышают иммунитет.
В клетках и тканях живых организмов встречается около 300 различных аминокислот, но только 20 из них служат звеньями (мономерами), из которых построены пептиды и белки всех организмов (поэтому их называют белковыми аминокислотами). Последовательность расположения этих аминокислот в белках закодирована в последовательности нуклеотидов соответствующих генов (см. Генетический код). Остальные аминокислоты встречаются как в виде свободных молекул, так и в связанном виде. Многие из аминокислот встречаются лишь в определенных организмах, а есть и такие, которые обнаруживаются только в одном из великого множества описанных организмов.
Триптофан
Лейцин
Лизин
Метионин
Фенилаланин
Изолейцин
Валин
Треонин
5. Уровни структурной организации.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка,
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[15]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
π-спирали; неупорядоченные фрагменты.
Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
