
- •Содержание
- •Введение
- •1. Получение материалов методом свс
- •1.1. Кинетика свс – процессов.
- •1.2. Термодинамика свс – процессов, расчет адиабатической температуры.
- •1.3. Исследование структуры волны горения, максимальной температуры и скорости распространения фронта термопарным методом.
- •Реактор свс и синтез карбида титана в самораспространяющемся режиме.
- •Синтез никелида алюминия в режиме теплового взрыва
- •3.Порядок выполнения работы Получение карбида титана
- •Получение никелида алюминия Расчет состава исходной смеси
- •Контрольные вопросы
- •Список литературы
- •Получение тугоплавких керамических материалов методом самораспространяющегося высокотемпературного синтеза
1.2. Термодинамика свс – процессов, расчет адиабатической температуры.
При протекании экзотермической реакции в режиме горения существуют критические условия. Поэтому в обычных условиях не всякая реакция, идущая с выделением тепла, протекает в самораспространяющемся режиме. Необходимыми условиями для этого являются: высокая экзотермичность реакции и сильная аррениусовская зависимость скорости реакции от температуры. Следует отметить, что более ста лет назад П. Бертело сформулировал принцип, согласно которому существуют условия, при которых любая экзотермическая реакция протекает в самораспространяющемся режиме.
При определении этих условий реализуют два подхода – термодинамический и макрокинетический. Макрокинетический подход основан на детальном рассмотрении механизма процесса с учетом всей совокупности физико – химических факторов. Этот подход, дает ответ на вопрос о возможности синтеза и реальных путях его проведения, но он связан с очень большими трудностями описания реальных систем. При термодинамическом подходе удается рассчитать адиабатическую температуру процесса и равновесный состав продуктов горения. Такие расчеты проводятся до постановки опытов, что особо важно для оценки возможности проведения высокотемпературного синтеза в режиме горения в различных системах.
Расчет максимальной температуры, развивающейся при синтезе, обычно проводят в предложении адиабатичности процесса, то есть отсутствия тепловых потерь из зоны реакции при полном превращении реагентов в конечные продукты. Эта схема расчета, как показывает практика, дает хорошие результаты при анализе процессов синтеза из элементов в бинарных системах, где состав продуктов в основном определяется фазовой диаграммой состояния. При исследовании более сложных систем, например с восстановительной стадией, необходимо использовать более сложные схемы расчета (рис. 2).
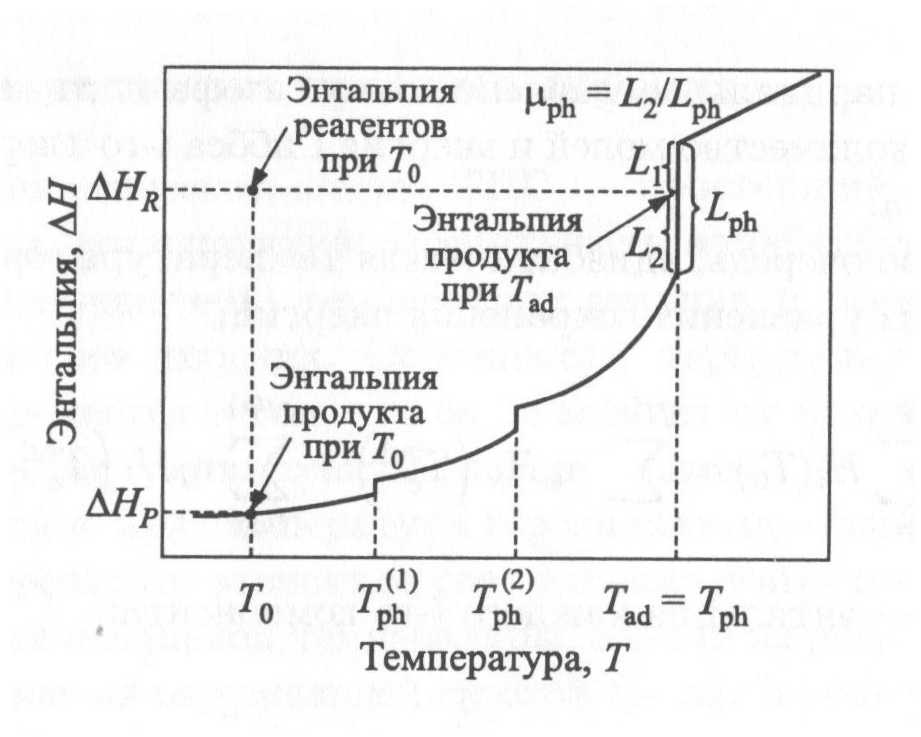
Рисунок 2Термодинамическая схема расчета СВС
При сделанных предположениях должно выполняться равенство энтальпий исходных веществ при начальной температуре Т₀ и конечных продуктов при Тад.

Тад, Т₀ - адиабатическая и начальная температура реакции;
Q ͓ - ее тепловой эффект.
Если образуется один продукт, например TiC при взаимодействии титана и углерода, это уравнение принимает вид:

Сp (T) – теплоемкость;
Q– теплота образования продукта при Т0;
n
– количество фазовых переходов в
интервале T0<T<Tad
;
 – теплота фазовых переходов в продукте
при
– теплота фазовых переходов в продукте
при
 ;
;
 и
и
 - соответственно теплота и доля
высокотемпературной фазы в продукте
при
- соответственно теплота и доля
высокотемпературной фазы в продукте
при
 .
Так
.
Так
 при
при
 и
и
 при
при

Для случая расчет адиабатической температуры ведут по следующей формуле:

где:
Tад – адиабатическая температура,
Т0 – начальная температура,
 – эффективный
тепловой эффект реакции,
– эффективный
тепловой эффект реакции,
 – усредненная
теплоемкость исходных веществ в диапазоне
температур T0-Tad.
– усредненная
теплоемкость исходных веществ в диапазоне
температур T0-Tad.
Например, в простейшем случае реакции синтеза карбида титана:
Ti + C = =TiC +Q, Q=3480 кДж/кг
при T0=300 К Tад = 3290 К
В случае легко определить долю высокотемпературной фазы в продукте горения:

Следует отметить, что деление систем на группы, предположенное для прогноза СВС, является весьма условным, так как протекание самораспространяющихся режимов горения в значительной степени зависит и от физической обстановки процесса – уровня тепловых потерь, скорости реагирования и др. Меняя эту обстановку, например уменьшая теплоотдачу за счет увеличения объема реагирующей системы или повышая скорость тепловыделения за счет уменьшения размера исходных компонентов, осуществляют синтез без подогрева и в системах, когда адиабатическая температура ниже температуры плавления образующегося продукта.
