
1. Участие трансфераз в реакциях конъюгации
Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы,
локализированные в основном в ЭР
присоединяют остаток глюкуроновой
кислоты к молекуле вещества, образованного
в ходе микросомального окисления
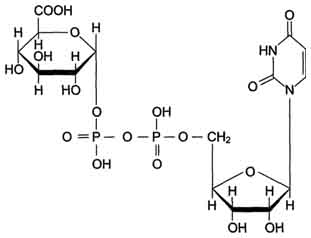
Уридиндифосфоглюкуроновая кислота (УДФ-C6H9O6).
В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так: ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Цитоплазматические сульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам. Реакция с участием сульфотрансферазы в общем виде записывается так: ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
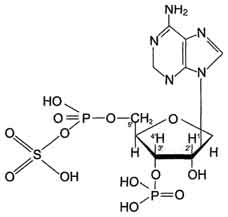
3'-Фосфоаденозин-5'-фосфосульфат(ФАФ-SО3Н).
Глутатионтрансферазы
Особое
место среди ферментов, участвующих в
обезвреживании ксенобиотиков, инактивации
нормальных метаболитов, лекарств,
занимают глутатионтрансферазы (ГТ).
Глутатионтрансферазы функционируют
во всех тканях и играют важную роль в
инактивации собственных метаболитов:
некоторых стероидных гормонов,
простагландинов, билирубина, жёлчных
кислот, продуктов ПОЛ. Известно множество
изоформ ГТ с различной субстратной
специфичностью. В клетке ГТ в основном
локализованы в цитозоле, но имеются
варианты ферментов в ядре и митохондриях.
Для работы ГТ требуется глутатион (GSH)
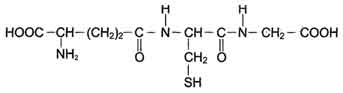
Глутатион (GSH) - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цистеину карбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. Она связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глутатиона подвергаются только те, которые имеют полярную группу. Т. е. субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
1. путём конъюгации субстрата R с глутатионом (GSH):
R + GSH → GSRH,
2. в результате нуклеофильного замещения: RX + GSH → GSR + НХ,
3. восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
4. в реакции: ООН - гидропероксидная группа,
GSSG - окисленный глутатион.
Система обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма
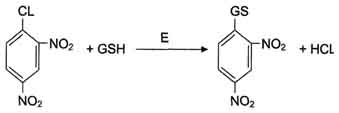
Обезвреживание 1-хлор, 2,4-динитробензола с участием глутатиона.
ГТ своими гидрофобными центрами могут нековалентно связывать огромное количество липофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка от ацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов.
Мембранные и цитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2 и SH-группы ксенобиотиков.
2. Вторая фаза обезвреживания веществ − реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков.
Во второй фазе обезвреживания (реакции конъюгации) принимают участие и некоторые другие ферменты. Эпоксидгидролаза (эпоксидгидратаза) присоединяет воду к эпоксидам бензола, бензпирена и другим полициклическим углеводородам, образованным в ходе первой фазы обезвреживания, и превращает их в диолы
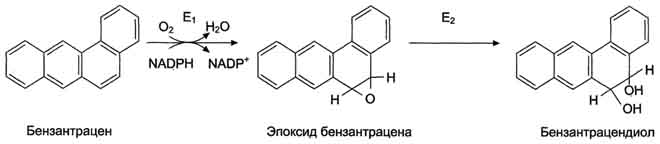
Обезвреживание бензантрацена. Е1 - фермент микросомальной системы; Е2 - эпоксидгидратаза.
Эпоксиды, образовавшиеся при микросомальном окислении, являются канцерогенами. Они обладают высокой химической активностью и могут участвовать в реакциях неферментативного алкилирования ДНК, РНК, белков. Химические модификации этих молекул могут привести к перерождению нормальной клетки в опухолевую.
Связывание, транспорт и выведение ксенобиотиков
В плазме крови множество как эндогенных, так и экзогенных липофильных веществ, которые транспортируются альбумином и другими белками.
Альбумин − основной белок плазмы крови, связывающий различные гидрофобные вещества. Он может функционировать в качестве белка-переносчика билирубина, ксенобиотиков, лекарственных веществ.
Помимо альбуминов, ксенобиотики могут транспортироваться по крови в составе липопротеинов, а также в комплексе с кислым α-1-гликопротеином. Особенность этого гликопротеина состоит в том, что он является индуцируемым белком, участвующим в ответной реакции организма на изменения, происходящие в состоянии стресса, например, при инфаркте миокарда, воспалительных процессах; его количество в плазме увеличивается наряду с другими протеинами. Связывая ксенобиотики, кислый α-1-гликопротеин инактивирует их и переносит в печень, где комплекс с белком распадается, и чужеродные вещества обезвреживаются и выводятся из организма.
Очень важный механизм выведения из клетки гидрофобных ксенобиотиков − функционирование Р-гликопротеина (транспортная АТФ-аза).
Р-гликопротеин − фосфогликопротеин с молекулярной массой 170 кД, присутствующий в плазматической мембране клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ-связывающих центра
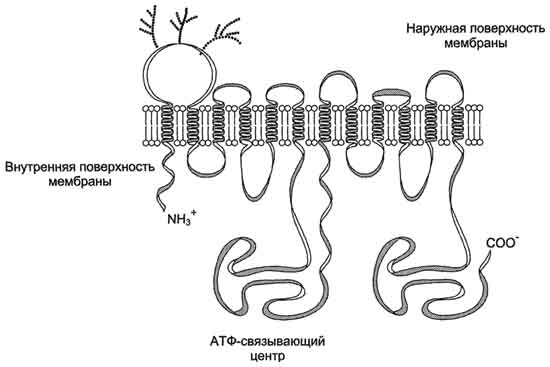
Строение Р-гликопротеина. Р-гликопротеин - интегральный белок, пронизывающих бислой цитоплазматической мембраны. N- и С-концы белка обращены в цитозоль. Участки Р-гликопротеина на наружной поверхности мембраны гликозипированы. Область между шестым и седьмым доменами имеет центры для присоединения АТФ и аутофосфорилирования.
В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток. Когда гидрофобное вещество (например, противоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р-гликопротеином с затратой энергии
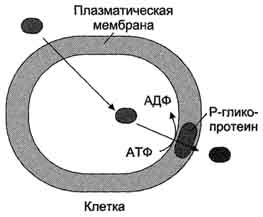
Функционирование Р-гликопротеина. Заштрихованный овал − противоопухолевое лекарство (гидрофобное вещество).Уменьшение количества лекарства в клетке снижает эффективность его применения при химиотерапии онкологических заболеваний.
