
16. Микросомальное окисление в физиологических и патологических процессах
В мембранах ЭР практически всех тканей локализована сисгема микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана последних распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ.
К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации.
Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями. Система обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован.
В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени.
Микросомальные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования.
Превращения ксенобиотиков − первая фаза − Схема реакций:
Гидроксилирование RH → ROH
Окисление по атому серы (сульфоокисление)
Окислительное дезаминирование RNH2 → R=O + NH3
Дезалкилирование по азоту, кислороду, сере RNHCH3 → RNH2 + H2C=O
ROCH3 → ROH + H2CO RSCH3 → RSH + H2CO
Эпоксидирование
![]()
Вторая фаза − реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами − глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
Микросомальное окисление
Микросомальные оксидазы − ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
1. Основные ферменты микросомальных электронтранспортных цепей
Микросомальная система не содержит растворимых в цитозоле белковых компонентов, все ферменты − мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Система включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов − NADPH-P-450 редуктазы и цитохрома Р-450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
Первая электронтранспортная цепь − NADPH-P450 редуктаза и цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента - флавинадениндинуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450- редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450 (см. схему ниже).
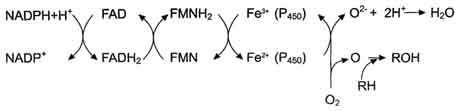
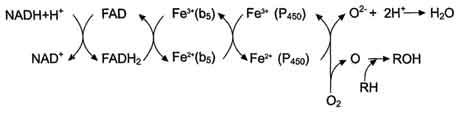
Во второй цепи окисляемый субстрат (донор электронов) для NADH-цитохром b5 -редуктазы − NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы − FAD, следующим акцептором электронов служит Fe3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р-450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды.

NADH-цитохром b5 редуктаза - двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу − кофермент FAD, а единственный гидрофобный "хвост" закрепляет белок в мембране.
Цитохром b5 − гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий "заякоренный" в липидном бислое спирализованный домен.
NADH-цитохром b5 -редуктаза и цитохром b5, являясь "заякоренными" белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
