
- •Ректификация
- •Равновесие в системах пар – жидкость
- •Смеси с неограниченной взаимной растворимостью (бинарные системы)
- •Фазовая диаграмма р-х
- •Д с максимумом давления с минимумом давления иаграммы
- •Перегонка
- •Способы подвода тепла в низ колонны
- •Циркулирующая горячая струя
- •1. Парциальный конденсатор
- •2. Выносной конденсатор-холодильник
- •3.Циркуляционное неиспаряющееся орошение
- •Материальный баланс процесса ректификации
- •Уравнения рабочих линий
- •Построение рабочих линий на y-X диаграмме
- •Минимальное и рабочее флегмовое число
- •Тепловой баланс процесса ректификации
- •Тепловой баланс дефлегматора
- •Ректификация многокомпонентных смесей
- •Экстрактивная и азеотропная ректификации
- •Принципиальная технологическая схема экстрактивной ректификации
- •Схемы непрерывно действующих ректификационных установок
- •Ректификация в аппарате, производящем только обогащение
- •Ректификация в аппарате, производящем только исчерпывание
Ректификация
Ректификация- разделение жидких однородных смесей на составляющие вещества в результате многократного противоточного взаимодействия паровой и жидкой фаз.
Разделение
жидкой смеси основано на различной
летучести
её компонентов, т.е. все компоненты смеси
обладают при данной температуре
определенным, но различным давлением
пара (в отличие от выпаривания). Поэтому
составы образующихся пара и конденсата
отличаются от состава жидкости (α =![]() => коэффициент относительной летучести).
=> коэффициент относительной летучести).
Наиболее простые - бинарные смеси, которые состоят из НКК и ВКК (легколетучего и труднолетучего компонентов). На практике чаще всего встречаются многокомпонентные смеси.
Простая перегонка – разделение жидких смесей путём однократного частичного испарения и конденсации образующихся паров. Простая перегонка применяется только для разделения смесей с большой разницей в летучести компонентов. Её используют обычно для предварительного грубого разделения.
Ректификация и перегонка являются типичными массообменными процессами.
Применение ректификации в промышленности:
Спиртовая
Нефтеперерабатывающая
Производства органического синтеза
Криогенная
Схема рассмотрения процесса ректификации:
Равновесие
Балансовые соотношения
Методы расчета
Конструкции оборудования
Равновесие в системах пар – жидкость
Рассмотрим бинарные смеси, не взаимодействующие химически друг с другом.
По правилу фаз, число степеней свободы равно:
С= К-Ф+2= 2-2+2=2
Из трех независимых параметров, определяющих состояние системы (t,p,c) только две можно выбрать произвольно, при этом определяется значение третьего параметра.
Поэтому для характеристики бинарных систем пользуются фазовыми диаграммами, содержащими равновесные зависимости:
Давление пара от состава жидкости: P-X ( t= const);
Температура кипения и конденсации от состава жидкости и пара:
T-X-Y (P=const);
Состава пара от состава жидкости: Y-X (P=const).
Вид этих зависимостей, характеризующих поведение жидкой смеси, зависит, в основном, от природы веществ, их взаимной растворимости.
Различают следующие смеси жидкостей:
С неограниченной взаимной растворимостью
Взаимно нерастворимые
Ограниченно растворимые
Смеси с неограниченной взаимной растворимостью (бинарные системы)
Эти смеси делятся на идеальные и реальные.
Идеальные
растворы характеризуются тем, что все
частицы в растворе ведут себя одинаково.
Для них справедливо соотношение:
![]() =
=![]() =
=![]() .
.
Закон Рауля:
Равновесная упругость компонента над раствором равна упругости насыщенного пара чистого компоненте, умноженной на его мольную долю в жидкости:
![]() =
=
![]()
![]() ;
;
![]() =
=
![]() (1-
);
(1-
);
где:
![]() -
равновесная упругость
-
равновесная упругость
![]() - упругость насыщенных паров чистого
компонента при данной температуре (по
справочникам)
- упругость насыщенных паров чистого
компонента при данной температуре (по
справочникам)
![]() - мольная доля компонента. А (НКК)
- мольная доля компонента. А (НКК)
По закону Дальтона общее давление есть сумма парциальных давлений компонентов:
П= + = + (1- )= +( - )
При постоянной температуре и постоянны, следовательно, , и П определяются только составом жидкости:
Фазовая диаграмма р-х
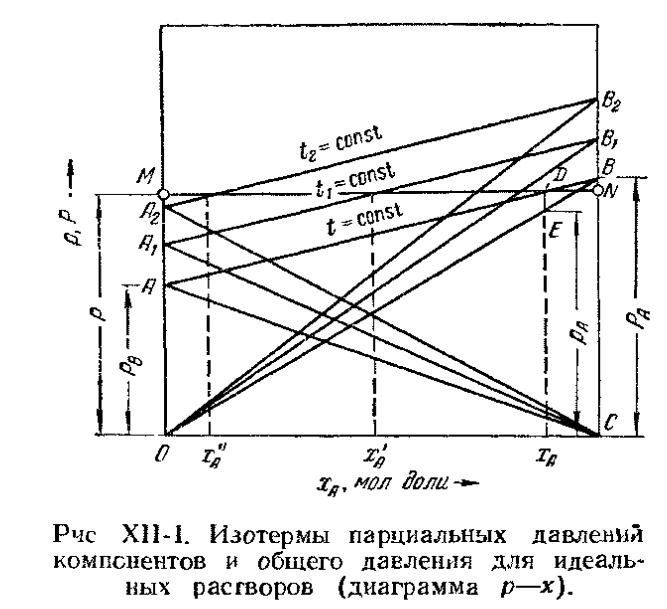
Построим фазовую диаграмму t-x-y. Очевидно, что при равновесии равновесная упругость пара над раствором равна нормальному давлению его в паре. Поэтому можно записать (по закону Дальтона):
=
П ![]()
=
П (1-![]() ),
),
где: - равновесная мольная доля компонента в паре, по закону Рауля: = ;
отсюда:
=
![]() Х;
Х;
)=
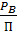 (1-
)
(1-
)
Диаграмма строится:
X=
![]() ;
Y=
x
;
Y=
x
При P=const, зная температуру, находят , , х, а затем у.
Нижняя ветвь отвечает температурам кипения жидкой смеси, а верхняя - температурам конденсации паровой фазы, при заданном давлении Р.
Для расчетов процесса ректификации чаще всего применяется фазовая диаграмма Y-X,
где: Y – мольная доля НКК в паре,
Х – мольная доля НКК в жидкости
Диаграмма Y-X строится обычно при П =const.
=
![]() =
=
![]() =
=
![]() ;
;
где:
α = ![]() ;
;
α – называется относительной летучестью ( при Р = const).
Таким
образом, равновесная зависимость ![]() =
f(x)
- кривая,
=
f(x)
- кривая,
≠ const
≠ const => при изменении температуры по высоте колоны (P= const, t≠const)

Положение равновесных линий обобщается законом Коновалова:
Пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается её температура кипения.
Таким образом, пар обогащается НКК, концентрация НКК в паре всегда при ректификации больше, чем в жидкости, а область, соответствующая ректификации, выше диагонали.
Реальные
смеси.
![]() ≠X
≠X
Реальные жидкие смеси с полной взаимной растворимостью не следуют закону Рауля.
Значительные
отклонения наблюдаются при высоких
температурах и давлениях. В этих случаях
вместо давления насыщенного пара ![]() вводят активности компонентов
вводят активности компонентов ![]() .
.
По сравнению с равновесной упругостью над идеальными растворами упругость пара над реальными растворами может быть больше -> положительное отклонение от закона Рауля, меньше -> отрицательное отклонение от закона Рауля.
Примеры растворов с положительным отклонением:
Азот-кислород, вода-метиловый спирт, CCl4-бензол, бензол-ацетон, ацетон-этиловый спирт, вода-этиловый спирт (95,57%)
С отрицательным отклонением:
Вода-азотная кислота 68% вес HNO3 – азеотропная смесь), вода-хлористый водород (20% HCl – азеотроп), хлороформ-ацетон, хлороформ-бензол.
Для смеси с положительным отклонением:
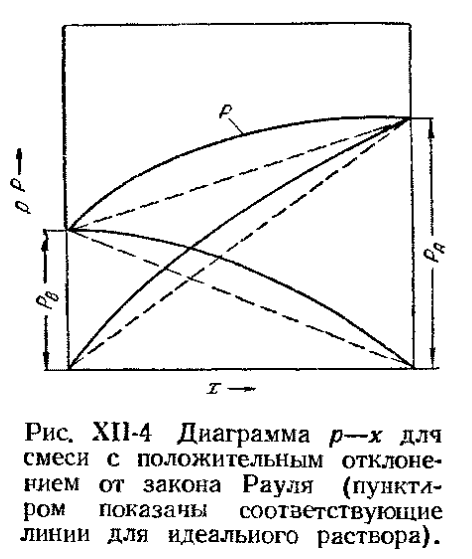
При положительных отклонениях разнородные молекулы взаимно притягиваются с меньшей силой, чем однородные, что облегчает переход молекул в паровую фазу ( по сравнению с чистыми жидкостями).
< ,
С отрицательным отклонением:
P
PA


PB

0
1
x
При отрицательных отклонениях разнородные молекулы притягиваются сильнее ( химические соединения, сольватация, водородные связи), что затрудняет переход молекул в паровую фазу.
< ,
Для ряда смесей большие количественные отклонения от закона Рауля приводят к качественно новым свойствам смесей.
При некотором составе кривая общего давления проходит через максимум или минимум. В этих точках составы паровой и жидкой фаз одинаковы (второй закон Коновалова), т.е. обогащения паровой фазы НКК не происходит. Такие растворы называются азеотропными (нераздельнокипящими). Состав их при перегонке не меняется, и они кипят при постоянной температуре.
