
- •Лекция 19 состав и физические свойства газа нефти и пластовых вод
- •Лекция 20
- •1.1. Состав природных газов
- •1.2. Физико-химические свойства углеводородных газов
- •Уравнения состояния природных газов
- •Растворимость газов в нефти и воде
- •Физико-химические свойства конденсата
- •Свойства пластовой нефти
- •Реологические характеристики нефтей и систем, применяемых при добыче нефти и газа
- •Нефтегазоводонасыщенность коллекторов и методы ее определения
- •Лекция 26 фазовые состояния углеводородных систем
- •Лекция 27 фазовые переходы в нефти, воде и газе
- •Лекция 28 молекулярно- поверхностные свойства системы нефть-газ—вода-порода
- •Лекция 29,30 физические основы вытеснения нефти, конденсата и газа из пористой среды
Уравнения состояния природных газов
Поведение газов описывается уравнением состояния, которое связывает между собой давление, объем, температуру и массу (количество молекул газа).
Для определения многих физических свойств природных газов используется уравнение состояния. Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
![]() , (3.18)
, (3.18)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная Па×м3/(кмоль×град).
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном (1 атм.) и близких к нормальному давлениях (10-12 атм.).
Как показали многочисленные исследования, поведение реальных природных газов может значительно отличаться от уравнения Клапейрона- Менделеева. При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения реального газа от идеального состояния:
![]() , (3.19)
, (3.19)
где Q – количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений и температуры). Обычно коэффициент сжимаемости определяется экспериментально как функция давления, температуры и состава газа.
При другом подходе для учета реальных свойств газа уравнение состояния усложняют. Так, например, известное уравнение Ван-дер-Ваальса учитывает объем молекул и межмолекулярные силы притяжения и для одного моля газа имеет вид

где
![]() – критические параметры.
– критические параметры.
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
![]() (3.20)
(3.20)
![]() (3.21)
(3.21)
z = f ( Тприв, Рприв) (3.22)
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
![]() . (3.23)
. (3.23)
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
![]() (3.24)
(3.24)
Вязкость газа – свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость m и кинематическую вязкость n. Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
![]() , (3.25)
, (3.25)
где r – плотность газа;
![]() – средняя длина пробега молекулы;
– средняя длина пробега молекулы;
![]() – средняя скорость молекул.
– средняя скорость молекул.
Кинематическая вязкость природного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза.
Динамическая вязкость газа увеличивается с ростом температуры (при повышении температуры увеличивается средняя скорость и длина пробега молекул), однако при давлении более 3 МПа вязкость с ростом температуры начинает снижаться. От давления вязкость газа практически не зависит (снижение скорости, и длины пробега молекул при увеличении давления компенсируется ростом плотности).
Диффузия газов определяется законом Фика

где q – плотность потока массы; D – коэффициент диффузии; С – концентрация диффундирующего компонента.
Коэффициенты взаимной диффузии газов (газ в газ) составляют порядка 10-4-10-5 м2/с. Диффузия газов в жидкости происходит значительно медленнее (~10-9-10-10 м2/с).
Тепловые свойства газов характеризуются теплоемкостью и теплопроводностью. При термодинамических расчетах используют два коэффициента теплоемкости: при постоянном давлении Ср и постоянном объеме Сv. Известно, что для идеальных газов справедливо соотношение Ср – CV = R, где R – газовая постоянная.
При температуре 100°С теплоемкость пентана составляет 2,02, азота – 1,04, бутана – 2,03, водяного пара – 1,95, кислорода – 0,94, метана – 2,45, пропана – 2,02 и этана – 2,07 кДж/(кг·°С).
Теплоемкость газовых смесей определяется аддитивным способом по формуле

где Ci – теплоемкость отдельных компонентов смеси газов; ni – их молярные доли.
Теплопроводность газов описывается законом Фурье

где q – плотность теплового потока; λ – коэффициент теплопроводности; Т – температура.
Важное значение в технологических процессах добычи имеет изменение температуры газа при его адиабатическом расширении (дросселировании), которое получило название дроссельного эффекта или эффекта Джоуля-Томсона. Соответствующая формула для понижения температуры ΔТ имеет вид
![]()
где α – коэффициент Джоуля-Томсона; Δp – снижение давления при адиабатическом расширении газа.
Для газов эта величина обычно положительна в отличие от жидкости и имеет порядок 10°С/МПа.
К тепловым свойствам природных газов относится также их удельная теплота сгорания – количество теплоты, выделяемое при сгорании единицы объема газа. Эта величина зависит от количества тяжелых компонентов в газе, увеличиваясь с их ростом. На рис. 2 приведена корреляционная зависимость удельной теплоты сгорания природных газов газовых и газоконденсатных месторождений Тюменской области и Европейского Севера от содержания компонентов C3H8 и выше.
Природные газосодержащие пласты всегда содержат воду, поэтому газ в пластовых условиях насыщен парами воды. При изменении условий в залежи с увеличением температуры и уменьшением давления количество водяных паров в газовой фазе увеличивается.
Различают абсолютное и относительное влагосодержание природных газов. Под абсолютным влагосодержанием понимается масса водяных паров в единице объема газа, приведенного к нормальным условиям. Таким образом, размерность этой величины совпадает с размерностью плотности. Относительное влагосодержание определяется отношением фактического содержания паров воды в единице объема газовой смеси при данных давлениях и температурах к количеству водяных паров в газе при тех же условиях и полном насыщении. Относительное влагосодержание выражается в %.
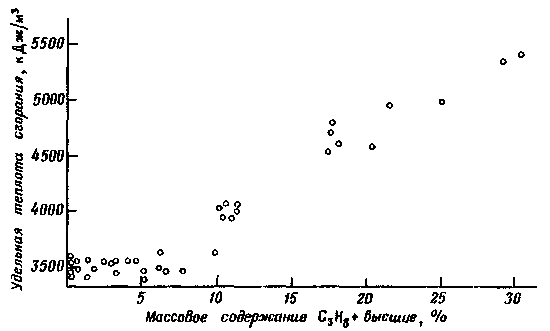
Рис. 2. Зависимость удельной теплоты сгорания газов от содержания в них тяжелых компонентов
