
- •Лекция 19 состав и физические свойства газа нефти и пластовых вод
- •Лекция 20
- •1.1. Состав природных газов
- •1.2. Физико-химические свойства углеводородных газов
- •Уравнения состояния природных газов
- •Растворимость газов в нефти и воде
- •Физико-химические свойства конденсата
- •Свойства пластовой нефти
- •Реологические характеристики нефтей и систем, применяемых при добыче нефти и газа
- •Нефтегазоводонасыщенность коллекторов и методы ее определения
- •Лекция 26 фазовые состояния углеводородных систем
- •Лекция 27 фазовые переходы в нефти, воде и газе
- •Лекция 28 молекулярно- поверхностные свойства системы нефть-газ—вода-порода
- •Лекция 29,30 физические основы вытеснения нефти, конденсата и газа из пористой среды
1.2. Физико-химические свойства углеводородных газов
К основным физическим свойствам природных газов относят плотность, вязкость, диффузию, теплопроводность, влагосодержание, которые зависят от состава газа и внешних условий (температуры и давления).
Различают молекулярную массу и плотность газа. Массу атомов и молекул условно измеряют в единицах. За единицу массы атома принята 1/12 массы изотопа углерода. Сумма атомных масс элементов, входящих в молекулу, называется молекулярной массой вещества.
Молекулярная масса вещества М связана с плотностью газа ρ, равной отношению М к объему моля газа, т.е. ρ = М/22,4.
Часто используется относительная плотность газов, т.е. отношение плотностей газа и воздуха:
![]()
где ρв = 1,293 кг/м3 – плотность воздуха при нормальных условиях: 29 – молекулярная масса воздуха.
Относительная плотность воздуха равна 1 г; гелия – 0,14, азота – 0,97; углекислого газа – 0,52; сероводорода – 1,19; метана – 0,55; этана – 1,04; пропана – 1,52, бутана – 2.
Нефтяной газ при нормальных условиях содержит неполярные углеводороды (смесь компонентов от С1 до С4), и с точки зрения физики к ним можно применять законы для идеальных систем. С точки зрения математики – это аддитивная система. Следовательно, к нему при нормальных условиях применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
![]() , (3.3)
, (3.3)
где gi – весовая доля;
Ni – мольная доля;
Vi – объёмная доля;
Пi – параметр i-го компонента.
Плотность смеси газов рассчитывается следующим образом:
![]() . (3.4)
. (3.4)
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля (gi) – отношение массы i-го компонента, содержащегося в системе к общей массе системы:
 (3.5)
(3.5)
Молярная (мольная) доля (Ni) – отношение числа молей i-го компонента к общему числу молей в системе:
 (3.6)
(3.6)
![]() , (3.7)
, (3.7)
где mi – масса i-го компонента;
Мi – молекулярный вес.
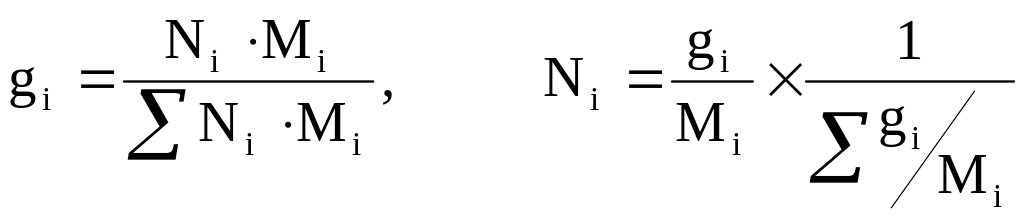 (3.8)
(3.8)
Объёмная доля (Vi) – доля, которую занимает компонент в объёме системы.
 (3.9)
(3.9)
Для идеального газа соблюдается соотношение Vi = Ni .
Молекулярная масса смеси рассчитывается следующим образом:
 (3.10)
(3.10)
Если плотность газа задана при атмосферном давлении (0,1013 МПа), то пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:
![]() . (3.12)
. (3.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
![]() , (3.13)
, (3.13)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
![]() . (3.14)
. (3.14)
![]() . (3.15)
. (3.15)
Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
![]() , (3.16)
, (3.16)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или
![]() . (3.17)
. (3.17)
