
- •Список сокращений
- •Введение
- •Обзор литературы
- •Повсеместное распространение патогенов в окружающей среде
- •1.2 Salmonella typhimurium – патоген человека и животных
- •1.3 Особенности ультраструктуры некультивируемых форм микроорганизмов
- •Способы переживания неблагоприятных условий бактериями
- •1.5 Голодание как основной фактор перехода бактерий в некультивируемое состояние
- •1.6 Формирование адаптивного ответа бактерий на стресс
- •1.7 Межклеточная коммуникация у бактерий рода Salmonella
- •1.8 RpoS глобальный регулятор системы ответа на стресс
- •Экспериментальная часть
- •2. Материалы и методы
- •2.1 Культивирование микроорганизмов
- •2.2 Оценка роста бактериальной культуры
- •2.3 Конструирование праймеров
- •2.4 Выделение днк
- •2.5 Спектрофотометрическое определение концентрации днк
- •2.6 Электрофорез днк в агарозном геле
- •2.7 Количественная полимеразная цепная реакция (кПцр)
- •2.8 Окрашивание клеток Salmonella Typhimurium 14028s wt витальными красителями и их анализ при помощи конфокальной флуоресцентной микроскопии
- •2.9 Приготовление проб для электронной микроскопии
- •2.10 Статистическая обработка данных
- •Результаты и обсуждение
- •3.1 Определение титра кое голодающей культуры s. Typhimurium.
- •3.2 Определение титра геномных копий (гк) голодающей культуры s. Typhimurium 14028s wt на основе количественного пцр
- •3.3 Оценка жизнеспособности клеток s. Typhimurium 14028s с помощью конфокальной флуоресцентной микроскопии
- •3.4 Морфологические особенности клеток голодающей популяции s. Typhimurium 14028s wt с низкой и высокой начальной плотностью
- •3.5 Оценка фенотипа клеток s. Typhimurium 14028s ΔluxS::KanR в условиях голодания
- •3.6 Оценка фенотипа клеток s. Typhimurium 14028s ΔrpoS::KanR в условиях голодания
- •Список использованной литературы
3.2 Определение титра геномных копий (гк) голодающей культуры s. Typhimurium 14028s wt на основе количественного пцр
Для оценки титра геномных копий (ГК) голодающих культур использовали разработанную нами тестовую систему на основе количественной полимеразной цепной реакции (в реальном времени). В качестве амплифицируемой области были выбраны последовательности рибосомного оперона S. typhimurium 14028S WT. Гены рРНК часто используют для диагностических приемов, что обусловлено их универсальностью, высокой степенью консервативности первичной структуры, функциональной стабильностью, сравнительной легкостью определения последовательностей. Кроме того, одной из особенностей структуры рибосомных генов является присутствие в их нуклеотидных последовательностях участков с различной степенью вариабельности.
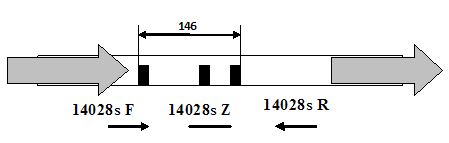

Рисунок 4. Схема рибосомного оперона S. typhimurium 14028S. Цифрами обозначены размеры участков в парах нуклеотидов.
На основе опубликованных во всемирной базе данных последовательностей нами была составлена схема участков рибосомных оперонов (рис. 4).
Для конструирования праймеров была выбрана вариабельная область межгенного спейсера 16S-23S рРНК. Эта некодирующая последовательность часто используется для систематики и филогении микроорганизмов и подходит для конструирования видоспецифичных праймеров для проведения диагностики. При подборе праймеров была использована программа Vector NTI. Ее возможности включают моделирование вторичной структуры олигонуклеотидов, расчет процентного содержания G-C пар, температуры плавления и отжига. Кроме того, программа определяет вероятность взаимодействия различных праймеров друг с другом и образования нежелательных димеров. В таблице 1 приведен список сконструированных нами праймеров и их основные характеристики.
Специфичность праймеров была проверена экспериментально. В качестве контролей на специфичность использовали ДНК микроорганизмов, имеющихся в коллекции нашей лаборатории (Xantomonas campestris, Azospirillum brasilense, Escherichia coli, P. atrosepticum SCRI1043), а также ДНК S. typhimurium 14028S WT. ПЦР с праймерами для S. typhimurium 14028S WT на ДНК других организмов в качестве контролей на специфичность показала, что с ДНК Azospirillum brasilense продукт не нарабатывался. На ДНК P. atrosepticum SCRI1043 и Escherichia coli появлялся неспецифичный продукт амплификации. Однако зонд в этой реакции не срабатывал, так как при постановке ПЦР РВ сигнала от контрольных ДНК матриц не наблюдали (рис.5). Во избежание потерь ДНК-мишеней при пробоподготовке, в качестве балласта добавляли 108 клеток Azospirillum brasilense. ДНК этого микроорганизма не являлась мишенью при проведении ПЦР с используемыми нами праймерами и флуоресцентными зондами и в ходе реакции образования продукта не обнаруживали.
Таблица 1. Характеристики видоспецифичных праймеров гомологичных области межгенного спейсера S. typhimurium 14028S WT.
Праймер |
Последовательность |
Длина, нукл. |
Температура отжига, оС |
14028s F |
ggtcggtggttcaagtccactcag |
24 |
60.6 |
14028s R |
CCCATCGTGTAGTCAGAACCTCTTTACC |
28 |
60.3 |
14028s Z (зонд) |
(c-FAM)tcacatac(t-BHQ1)gatgtatg Cttcgttattccacgccttg |
38 |
70.6 |

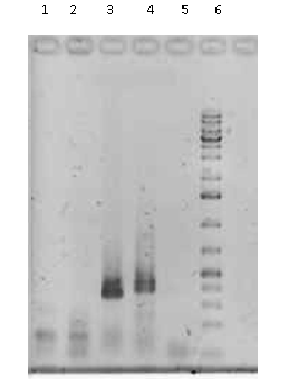
Рисунок 5. Электрофореграмма продуктов амплификации ДНК различных организмов с видоспецифичными праймерами на рибосомный оперон S. typhimurium 14028s 1-2 - S. typhimurium 14028S WT; 3 - Azospirillum brasilense; 4 - Escherichia coli; 5 - Pectobacterium atrosepticum; 6 - контроль, не содержащий ДНК; 5 - маркер молекулярной массы.
При проведении количественного ПЦР анализа использовали методику TaqMan ПЦР. Для этого конструировали флуоресцентный зонд, комплементарный амплифицируемой области. К его 5' концу присоединяется флуоресцентная метка – 6-карбокси флуоресцеин (FAM). На расстоянии одного витка спирали ДНК (10 п.н.) присоединяется гаситель (BHQ-1), вследствие чего зонд не флюоресцирует в зеленой области при возбуждении FAM. В ходе ПЦР на стадии элонгации зонд разрушается за счет 5'-3' экзонуклеазной активности Taq полимеразы. При этом флуоресцентный краситель и гаситель пространственно разъединяются, и в реакционной смеси генерируется флуоресценция, коррелирующая с образованием ампликона и детектируемая оптической системой амплификатора.
Кинетическая кривая, отражающая накопление ПЦР-продукта, представляет собой экспоненту, а номер цикла реакции, при котором кривая переходит на стадию экспоненциального роста, зависит от исходного количества ДНК-мишеней. Это позволяет проводить не только качественную, но и количественную оценку. Для ее проведения в качестве источника мишеней для ПЦР-РВ использовали серию десятикратных разведений ДНК S. typhimurium 14028S WT известной концентрации. По результатам реакции на этих образцах автоматически строится калибровочная кривая посредством пакета программ iCycler IQ v. 3.1.7050 (BIO-RAD, США). Поскольку калибровочная кривая, построенная на основе реакций с контрольными образцами ДНК с известной концентрацией, представляла собой линейную зависимость, данная тестовая система подходила для оценки количества ДНК-мишеней в исследуемых образцах (рис. 6).
Пересчет концентрации ДНК на титр ГК проводили при помощи программы, доступной в Интернете на страничке http://www.molbiol.ru/scripts/01_07.html.

Рисунок 6. А. Кинетические кривые накопления продуктов амплификации в ходе ПЦР с: 1 – образцами ДНК с известным титром ГК, 2 – опытным образцом (лизат клеток), 3 – образцом, не содержащим ДНК.
Б. Калибровочная кривая, построенная по результатам ПЦР-РВ с образцами с известным титром ГК.
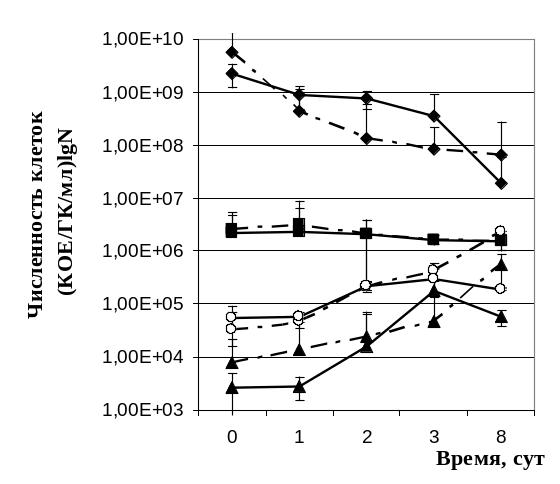

Рисунок
7. Динамика титра КОЕ (![]() )
и геномных копий ( ) в культуре клеток
S.
typhimurium
14028S WT,
инкубированных в минеральной безуглеродной
среде АВ при различной плотности
инокуляции: 2×109
– 5,7×109
(♦), 2,19×106
– 2,58×106
(■), 5,4×104
– 3,2×104
(○), 2,7×103
– 8×103
(∆) КОЕ/ГК/мл.
)
и геномных копий ( ) в культуре клеток
S.
typhimurium
14028S WT,
инкубированных в минеральной безуглеродной
среде АВ при различной плотности
инокуляции: 2×109
– 5,7×109
(♦), 2,19×106
– 2,58×106
(■), 5,4×104
– 3,2×104
(○), 2,7×103
– 8×103
(∆) КОЕ/ГК/мл.
Анализ титра геномных копий голодающих культур S. typhimurium 14028S различной начальной плотности проводили параллельно с подсчетом титра КОЕ. Динамика титра КОЕ культур голодающих при начальной плотности 104–107 КОЕ/мл соответствовала динамике титра геномных копий, определяемых при помощи ПЦР РВ. Следовательно, увеличение численности клеток на безуглеродной среде сопряжено с процессами репликации ДНК (Рис. 7). В культуре клеток S. typhimurium 14028S WT высокой плотности инокуляции происходило уменьшение количества выявляемых геномных копий, что характеризует процесс автолиза и образования покоящихся форм.
